
| 實驗現象 |
| (A) |
| (B)反應不十分強烈,產生的氣體可在空氣中燃燒 |
| (C)劇烈反應,產生可燃性氣體 |
| (D)生成白色膠狀沉淀,然后沉淀消失 |
| (E)產生氣體,可在空氣中燃燒,溶液變成淺紅色 |
| 實驗方案 |
| 1.用砂紙打磨后的鎂帶加適量水加熱,再向反應后溶液中滴加酚酞 |
| 2.鈉與滴有酚酞的試液的冷水反應 |
| 3.鎂帶與2mol/L的鹽酸反應 |
| 4.鋁條與2mol/L的鹽酸反應 |
| 5.向氯化鋁溶液中滴加氫氧化鈉溶液至過量 |
分析 (1)根據題意“某同學做同周期元素性質遞變規律實驗時”以及所做實驗可以判斷,本實驗的實驗目的是:驗證第三周期金屬元素的金屬性的遞變規律;
(2)1、用砂紙擦后的鎂帶與沸水反應,再向反應液中滴加酚酞,其現象應是:有氣體產生,產生的氣體可在空氣中燃燒,溶液變成淺紅色,即E;
2、鈉與滴有酚酞試液的冷水反應,反應方程式是2Na+H2O═2NaOH+H2↑,其離子方程式是2Na+H2O═2Na-+2OH-+H2↑,其現象應該是:浮于水面,熔成小球,在水面上無定向移動,隨之消失,溶液變成紅色;
3、鎂帶與2mol/L的鹽酸反應,其現象應是:劇烈反應,產生的氣體可以在空氣中燃燒,即C,值得注意的是鎂比鋁活潑,因此與鹽酸反應,鎂比鋁劇烈;
4、鋁條與2mol/L的鹽酸反應,其化學方程式是2Al+6HCl═2AlCl3+3H2↑,即離子方程式是2Al+6H+═2Al3++3H2↑,其現象是:反應不十分劇烈,產生的氣體可以在空氣中燃燒,即B;
5、向氯化鋁溶液中滴加氫氧化鈉溶液至過量,其現象:生成氫氧化鋁白色膠狀沉淀,繼而在氫氧化鈉過量時氫氧化鋁與氫氧化鈉反應使沉淀消失,即D;
(3)根據實驗1、2,說明與水反應時鈉比鎂劇烈,即鈉的金屬性比鎂強.根據3、4,說明與同濃度的鹽酸反應,鋁比鎂劇烈,即鋁的金屬性比鎂強,5說明氫氧化鋁既能與酸反應,又能與堿反應,即氫氧化鋁既有酸性又有堿性,因此鋁既有金屬性又有非金屬性.
解答 解:(1)根據題意“某同學做同周期元素性質遞變規律實驗時”以及所做實驗可以判斷,本實驗的實驗目的是:驗證第三周期金屬元素的金屬性的遞變規律.
故答案為:驗證第三周期金屬元素的金屬性的遞變規律;
(2)1、用砂紙擦后的鎂帶與沸水反應,再向反應液中滴加酚酞,其現象應是:有氣體產生,產生的氣體可在空氣中燃燒,溶液變成淺紅色,即E;
2、鈉與滴有酚酞試液的冷水反應,反應方程式是2Na+H2O═2NaOH+H2↑,其離子方程式是2Na+H2O═2Na-+2OH-+H2↑,其現象應該是:浮于水面,熔成小球,在水面上無定向移動,隨之消失,溶液變成紅色;
3、鎂帶與2mol/L的鹽酸反應,其現象應是:劇烈反應,產生的氣體可以在空氣中燃燒,即C,值得注意的是鎂比鋁活潑,因此與鹽酸反應,鎂比鋁劇烈;
4、鋁條與2mol/L的鹽酸反應,其化學方程式是2Al+6HCl═2AlCl3+3H2↑,即離子方程式是2Al+6H+═2Al3++3H2↑,其現象是:反應不十分劇烈,產生的氣體可以在空氣中燃燒,即B;
5、向氯化鋁溶液中滴加氫氧化鈉溶液至過量,其現象:生成氫氧化鋁白色膠狀沉淀,繼而在氫氧化鈉過量時氫氧化鋁與氫氧化鈉反應使沉淀消失,即D;剩余的A,所以2對應A;A的現象為:鈉浮在水面上,熔化化成小球,四處游動,發出嘶嘶響聲,溶液變紅,
故答案為:E、A、C、B、D;鈉浮在水面上,熔化化成小球,四處游動,發出嘶嘶響聲,溶液變紅;
(3)根據實驗1、2,說明與水反應時鈉比鎂劇烈,即鈉的金屬性比鎂強.根據3、4,說明與同濃度的鹽酸反應,鋁比鎂劇烈,即鋁的金屬性比鎂強,5說明氫氧化鋁既能與酸反應,又能與堿反應,即氫氧化鋁既有酸性又有堿性,因此鋁既有金屬性又有非金屬性;由以上分析第三周期,金屬元素的金屬性由強到弱的順序是:Na>Mg>Al,即同周期從左到右元素的金屬性逐漸減弱,
故答案為:同周期從左到右元素的金屬性逐漸減弱.
點評 本題把金屬元素的性質與實驗結合起來,探究同周期元素金屬性的遞變規律,具有較大的思維容量,能較好地訓練學生比較、歸納、分析、思考的能力.


科目:高中化學 來源: 題型:推斷題
| 面粉酸度 | <2° | 2°-4.5° | >4.5° |
| 面粉品質 | 新鮮面粉 | 陳年面粉 | 霉變面粉 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
| 實驗序號 | 實驗 | 實驗現象 | 結論 |
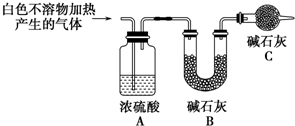
| 實驗Ⅱ | 將實驗Ⅰ中收集到的氣體點燃 | 安靜燃燒,火焰呈淡藍色 | 氣體成分為氫氣 |
| 實驗Ⅲ | 將實驗Ⅰ中的白色不溶物濾出、洗滌,取少量加入足量稀鹽酸 | 產生氣泡沉淀全部溶解 | 白色不溶物中含有MgCO3 |
| 實驗Ⅳ | 取實驗Ⅲ中的濾液,向其中加入適量CaCl2或BaCl2稀溶液 | 產生白色沉淀,溶液紅色變淺 | 溶液中存在CO${\;}_{3}^{2-}$ |
查看答案和解析>>
科目:高中化學 來源: 題型:計算題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 該有機物分子中碳、氫、氧原子個數比為1:2:3 | |
| B. | 該有機物分子中碳、氫原子個數比為1:2 | |
| C. | 該有機物中必含氧元素 | |
| D. | 該有機物中可能不含氧元素 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 在酒精燈加熱條件下,Na2CO3、NaHCO3固定都能發生分解 | |
| B. | 不可用元素周期律解釋熱穩定性:Na2CO3>NaHCO3 | |
| C. | 分別加熱Na2CO3和NaHCO3固體,試管內壁均有水珠,則兩種物質均受熱分解 | |
| D. | 1L0.1mol•L-1NaHCO3溶液中HCO3-和CO32-離子數之和為0.1NA |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com