
分析 步驟1 將廢鐵屑放入碳酸鈉溶液中煮沸除油污,碳酸鈉溶液中碳酸根離子水解導致溶液呈堿性,堿有利于油脂水解,鐵和碳酸鈉不反應,然后分離出液體,用水洗凈鐵屑;
步驟2 向處理過的鐵屑中加入過量的3mol•L-1H2SO4溶液,發生的反應為Fe+H2SO4=FeSO4+H2↑,在60℃左右使其反應到不再產生氣體,趁熱過濾,得FeSO4溶液;
步驟3 向所得FeSO4溶液中加入飽和(NH4)2SO4溶液,經過“一系列操作”后得到硫酸亞鐵銨晶體;
(1)步驟1的操作是加熱、溶解,根據儀器的作用選取儀器;
(2)硫酸亞鐵的溶解度隨著溫度的升高而增大;
(3)在步驟3制的硫酸亞鐵銨晶體常含有Fe3+雜質,Fe3+的試劑可以用K4〔Fe(CN)6〕生成普魯士藍沉淀,根據反應物和生成物書寫離子方程式;
(4)制得的晶體在無水乙醇中的溶解度小于在蒸餾水水中的溶解度;且乙醇揮發性較好;
(5)在25℃時,相同物質的量濃度的(NH4)2CO3、(NH4)2SO4、硫酸亞鐵銨三種鹽溶液a、b、c,其銨根離子水解程度越大,則溶液中銨根離子濃度越小.
解答 解:步驟1 將廢鐵屑放入碳酸鈉溶液中煮沸除油污,碳酸鈉溶液中碳酸根離子水解導致溶液呈堿性,堿有利于油脂水解,鐵和碳酸鈉不反應,然后分離出液體,用水洗凈鐵屑;
步驟2 向處理過的鐵屑中加入過量的3mol•L-1H2SO4溶液,發生的反應為Fe+H2SO4=FeSO4+H2↑,在60℃左右使其反應到不再產生氣體,趁熱過濾,得FeSO4溶液;
步驟3 向所得FeSO4溶液中加入飽和(NH4)2SO4溶液,經過“一系列操作”后得到硫酸亞鐵銨晶體;
(1)步驟1的操作是加熱、溶解,加熱需要酒精燈、盛放液體需要錐形瓶、需要玻璃棒攪拌、需要鐵架臺放置錐形瓶,所以不需要的儀器是②④⑤,故答案為:②④⑤;
(2)硫酸亞鐵的溶解度隨著溫度的升高而增大,為了減少硫酸亞鐵的析出,應該趁熱過濾,故答案為:防止溶液冷卻時,硫酸亞鐵因析出而損失;
(3)在步驟3制的硫酸亞鐵銨晶體常含有Fe3+雜質,Fe3+的試劑可以用K4〔Fe(CN)6〕生成普魯士藍沉淀,離子反應方程式為K++Fe3++[Fe(CN)6]4-=KFe[Fe(CN)6]↓,
故答案為:K++Fe3++[Fe(CN)6]4-=KFe[Fe(CN)6]↓;
(4)制得的晶體在無水乙醇中的溶解度小于在蒸餾水水中的溶解度;且乙醇揮發性較好,所以用乙醇洗滌能減小晶體因溶解而損失,故答案為:
①硫酸亞鐵銨晶體在乙醇中的溶解度小,可減小晶體在洗滌時應溶解而損失;
②酒精易揮發,不會附著在晶體表面;
(5)在25℃時,相同物質的量濃度的(NH4)2CO3、(NH4)2SO4、硫酸亞鐵銨三種鹽溶液a、b、c,其銨根離子水解程度越大,則溶液中銨根離子濃度越小,亞鐵離子抑制銨根離子水解、碳酸根離子促進銨根離子水解,所以溶液中銨根離子濃度從小到大順序是a<b<c,故答案為:a<b<c.
點評 本題考查物質制備實驗方案,為高頻考點,涉及基本操作、鹽類水解、離子檢驗等知識點,明確實驗原理是解本題關鍵,知道鐵離子、亞鐵離子的檢驗方法,題目難度不大.


科目:高中化學 來源: 題型:解答題
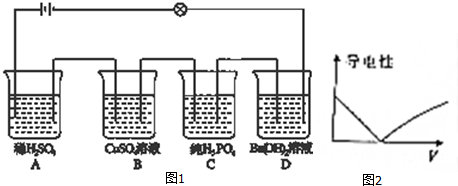
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題

| 沉淀物 | Fe(OH)3 | Fe(OH)2 | A1(OH)3 |
| 開始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
| A. | 反應在前50 s 的平均速率v(PCl3)=0.0032 mol•L-1•s-1 | |
| B. | 保持其他條件不變,升高溫度,平衡時c(PCl3)=0.11 mol•L-1,則反應的H<0 | |
| C. | 相同溫度下,起始時向容器中充入1.0 mol PCl5、0.20 mol PCl3 和0.20 mol Cl2,反應達到平衡前 v(正)>v(逆) | |
| D. | 相同溫度下,起始時向容器中充入2.0 mol PCl3和2.0 mol Cl2,達到平衡時,PCl3 的轉化率小于80% |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 離子 | SO42- | Mg2+ | Fe3+ | Na+ | Cl- |
| 濃度(mol/L) | a | 0.05 | 0.10 | 0.50 | 0.58 |
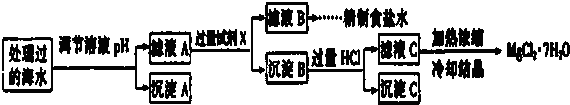
查看答案和解析>>
科目:高中化學 來源: 題型:解答題


查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 加催化劑,使N2和H2在一定條件下轉化為NH3 | |
| B. | 增大壓強,有利于SO2和O2反應生成SO3 | |
| C. | 由H2、I2(g)、HI(g)氣體組成的平衡體系加壓后顏色變深 | |
| D. | 黃綠色的氯水光照后顏色變淺 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 過氧化鈉、氯水、濃硝酸通常都要密封保存于棕色試劑瓶中 | |
| B. | 盛溴的試劑瓶里加少量水以減少溴的揮發 | |
| C. | 鉀、鈉、白磷都應保存在水中 | |
| D. | 做焰色反應實驗時所用鉑絲,每次用完后用稀硫酸洗滌后再使用 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com