
分析 (1)混合溶液中存在電荷守恒c(CN-)+c(OH-)=c(Na+)+c(H+),因為c(CN-)<c(Na+),所以c(OH-)>c(H+),混合溶液呈堿性,說明HCN的電離程度小于CN-的水解程度;
(2)①HCl是一元強酸,硫酸是二元強酸,醋酸是一元弱酸,pH相等的這三種酸中,強電解質溶液濃度小于弱電解質,強電解質溶液中,酸濃度與其酸的元數成反比;
②分別用0.1 mol•L-1的NaOH(aq)中和,消耗NaOH(aq)的體積與氫離子的物質的量成正比;
③反應速率與氫離子濃度成正比;
(3)純水中c(H+)=c(OH-),水的離子積Kw=c(H+).c(OH-);
對應酸的酸性越弱,其鹽的水解程度越大,溶液的堿性越強,溶液pH越大;當pH相同時,酸越強,鹽的濃度越大.
解答 解:(1)混合溶液中存在電荷守恒c(CN-)+c(OH-)=c(Na+)+c(H+),因為c(CN-)<c(Na+),所以c(OH-)>c(H+),混合溶液呈堿性,說明HCN的電離程度小于CN-的水解程度,所以c (HCN)>c (CN-);
故答案為:>;>;
(2)①HCl是一元強酸,硫酸是二元強酸,醋酸是一元弱酸,pH相等的這三種酸中,強電解質溶液濃度小于弱電解質,強電解質溶液中,酸濃度與其酸的元數成反比,所以pH值相同的 HCl(aq)、H2SO4(aq)、CH3COOH(aq)溶液其濃度大小順序是CH3COOH>HCl>H2SO4,則濃度最大的是CH3COOH;
故答案為:CH3COOH;
②分別用0.1 mol•L-1的NaOH(aq)中和,消耗NaOH(aq)的體積與氫離子的物質的量成正比,pH相等、體積相等的硫酸和鹽酸中氫離子的物質的量相等,醋酸的物質的量濃度最大,則相同體積同pH的醋酸和鹽酸,醋酸的物質的量大于鹽酸,所以消耗氫氧化鈉體積最多的是CH3COOH;
故答案為:CH3COOH;
③反應速率與氫離子濃度成正比,開始時,三種酸中氫離子濃度相等,所以其開始反應速率相等,故答案為:D;
(3)任何溫度下,純水均顯中性,即純水中都存在c(H+)=c(OH-)=2.0×10-7 mol•L-1,水的離子積Kw=c(H+).c(OH-)=2.0×10-7×2.0×10-7=4.0×10-14;在相同的條件下測得①NaHCO3 ②CH3COONa ③NaClO三種溶液pH相同,已知酸性:CH3COOH>HClO>HCO3-,所以水解程度:NaClO>NaHCO3>CH3COONa,pH相同時,溶液的濃度:NaClO<NaHCO3<CH3COONa,即②>①>③.
故答案為:2.0×10-7,②①③.
點評 本題考查較綜合,涉及弱電解質的電離、酸堿混合溶液定性判斷、反應速率的判斷、純水顯中性來求算水的離子積kw以及鹽溶液“越弱越水解:的規律等知識點,題目難度中等,側重于考查學生對基礎知識的綜合應用能力.


科目:高中化學 來源: 題型:解答題
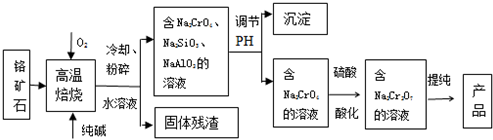
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 氟是非金屬性最強的元素.
氟是非金屬性最強的元素.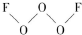 ,其中氧原子采用的軌道雜化方式是sp3,又如O2F2是一種強氧化劑,運用VSEPR模型判斷O2F2是極性(填“極性”或“非極性”)分子.
,其中氧原子采用的軌道雜化方式是sp3,又如O2F2是一種強氧化劑,運用VSEPR模型判斷O2F2是極性(填“極性”或“非極性”)分子.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1.0mol•L-1 | B. | 0.8mol•L-1 | C. | 0.6mol•L-1 | D. | 0.4mol•L-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
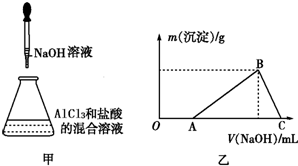 某同學稱取一定質量的AlCl3固體配成溶液,在該溶液中加入一定量的稀鹽酸,然后向此混合溶液中逐滴加入NaOH溶液如圖甲所示.滴加過程中產生沉淀的質量與加入NaOH溶液的體積的關系如圖乙所示.
某同學稱取一定質量的AlCl3固體配成溶液,在該溶液中加入一定量的稀鹽酸,然后向此混合溶液中逐滴加入NaOH溶液如圖甲所示.滴加過程中產生沉淀的質量與加入NaOH溶液的體積的關系如圖乙所示.查看答案和解析>>
科目:高中化學 來源: 題型:填空題
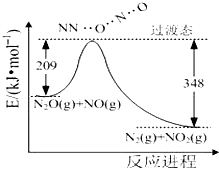 氨是合成硝酸、銨鹽和氮肥的基本原料,回答下列問題:
氨是合成硝酸、銨鹽和氮肥的基本原料,回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
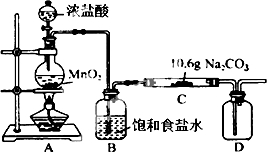 某化學活動小組設計如圖所示(部分夾持裝置已略去)實驗裝置,以探究潮濕的Cl2與Na2CO3反應得到的固體物質.
某化學活動小組設計如圖所示(部分夾持裝置已略去)實驗裝置,以探究潮濕的Cl2與Na2CO3反應得到的固體物質.| 步驟 | 預期現象和結論 |
| 步驟1:取C中少量樣品于試管中,滴加足量蒸餾水 至溶解,然后將所得溶液分別置于A、B試管中 | 固體物質全部完全溶解 |
| 步驟:向A試管中滴加適量BaCl溶液 | a. 如果 b. 如果 |
| 步驟: | 有白色沉淀生成,C的部分有NaCl |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 生成氯氣的相對分子質量為71 | B. | 生成1 mol氯化鉀轉移5 NA個電子 | ||
| C. | 生成氯化鉀的摩爾質量為76 g/mol | D. | 1molH37Cl參加反應轉移NA個電子 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com