
【題目】電解合成 1 , 2-二氯乙烷的實驗裝置如圖所示。下列說法中正確的是

A. 該裝置工作時,化學能轉變為電能
B. CuCl2能將C2H4還原為 l , 2-二氯乙烷
C. X、Y依次為陽離子交換膜、陰離子交換膜
D. 該裝置總反應為CH2CH2 + 2H2O + 2NaCl![]() H2 + 2NaOH + ClCH2CH2Cl
H2 + 2NaOH + ClCH2CH2Cl
【答案】D
【解析】
A. 該裝置為外加電源的電解池原理;
B. 根據裝置圖易知,陽極生成的CuCl2與C2H4發生了氧化還原反應,根據化合價的升降判斷該氧化還原反應的規律;
C. 根據電解池陰陽極發生的電極反應式及溶液電中性原則分析作答;
D. 根據具體的電解反應與氧化還原反應綜合寫出該裝置的總反應。
A. 該裝置為電解池,則工作時,電能轉變為化學能,故A項錯誤;
B. C2H4中C元素化合價為-2價,ClCH2CH2Cl中C元素化合價為-1價,則CuCl2能將C2H4氧化為1,2一二氯乙烷,故B項錯誤;
C. 該電解池中,陽極發生的電極反應式為:CuCl - e- + Cl-= CuCl2,陽極區需要氯離子參與,則X為陰離子交換膜,而陰極區發生的電極反應式為:2H2O + 2e- = H2↑+ 2OH-,有陰離子生成,為保持電中性,需要電解質溶液中的鈉離子,則Y為陽離子交換膜,故C項錯誤;
D. 該裝置中發生陽極首先發生反應:CuCl - e- + Cl-= CuCl2,生成的CuCl2再繼續與C2H4反應生成1,2一二氯乙烷和CuCl,在陽極區循環利用,而陰極水中的氫離子放電生成氫氣,其總反應方程式為:CH2=CH2+2H2O+2NaCl![]() H2+2NaOH+ClCH2CH2Cl,故D項正確;
H2+2NaOH+ClCH2CH2Cl,故D項正確;
答案選D。


科目:高中化學 來源: 題型:
【題目】金是一種用途廣泛的貴重金屬。某化工廠利用氰化法從一種含金礦石中提取金的工藝流程如下:
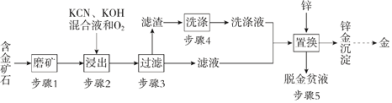
資料:
① Zn + ![]() O2 + H2O = Zn(OH)2
O2 + H2O = Zn(OH)2
② Zn2+(aq) ![]() Zn(CN)2(s)
Zn(CN)2(s) ![]() Zn(CN)42-(aq)
Zn(CN)42-(aq)
(1)步驟2中發生的反應有:
① 2Au(s) + 4CN-(aq) + 2H2O(l) + O2(g) = 2Au(CN)2-(aq) + 2OH-(aq) + H2O2(aq) H = -197.61 kJ·mol-1
② 2Au(s) + 4CN-(aq)+ H2O2(aq) = 2Au(CN)2-(aq) + 2OH-(aq) H = -386.93 kJ·mol-1
則2Au(s)+ 4CN-(aq)+ H2O(l) + 1/2O2(g) = 2Au(CN)2-(aq) + 2OH-(aq)的H =_______。
(2)下圖是步驟2中金的溶解速率與溫度的關系。80℃以后溶解速率降低的原因是___________。
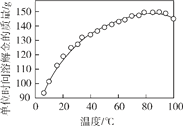
(3)步驟4的目的是_________________。
(4)步驟5置換的總反應是:
2Au(CN)2- + 3Zn + 4CN- + 2H2O = 2Au + 2Zn(CN)42- + ZnO22- + 2H2↑
則以下說法正確的是________(填字母序號)。
A 步驟5進行時要先脫氧,否則會增加鋅的用量
B 若溶液中c(CN-)過小,會生成Zn(CN)2,減緩置換速率
C 實際生產中加入適量Pb(NO3)2的目的是形成原電池加快置換速率
(5)脫金貧液(主要含有CN-)會破壞環境,影響人類健康,可通過化學方法轉化為無毒廢水凈化排放。堿性條件下,用Cl2將貧液中的CN-氧化成無毒的CO2和N2,該反應的離子方程式為_______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化合物H是某些姜科植物根莖的提取物,具有抗腫瘤、抗菌、抗氧化等功效,其一種合成路線如下:

已知:i 質譜圖顯示有機物D的最大質荷比為94,且D遇FeCl3溶液顯紫色
ii RMgBr+R′CHO→![]()
回答下列問題:
(1)D的化學式為___________;B的名稱為___________。
(2)反應①的反應類型是___________:I中所含官能團的名稱為___________。
(3)反應④的化學方程式是______________________。
(4)X是H的同系物,其相對分子質量比H小14,則X的同分異構體中,符合下列條件的有___________種(不含立體異構)
a.屬于芳香族化合物 b.能發生水解反應 c.能發生銀鏡反應
其中核磁共振氫譜有4組峰,且峰面積之比為6:2:1:1的結構簡式是___________(寫一種即可)。
(5)補充完成由甲苯和丙醛為原料,制備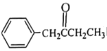 的合成路線(無機試劑任選)
的合成路線(無機試劑任選) ____________
____________ 
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下述實驗不能達到預期實驗目的是( )
序號 | 實驗內容 | 實驗目的 |
A | 將2.5gCuSO4.5H2O溶解在97.5g水中 | 配制質量分數為1.6%的CuSO4溶液 |
B | 向盛有1mL硝酸銀溶液的試管中滴加NaCl溶液,至不再有沉淀生成,再向其中滴加Na2S溶液 | 說明一種沉淀能轉化為另一種溶解度更小的沉淀 |
C | 室溫下,用pH試紙測定濃度為0.1mol.L-1NaClO溶液和0.1mol?L-1CH3COONa溶液的pH | 比較HClO和CH3COOH的酸性強弱 |
D | 室溫下,分別向2支試管中加入相同體積、相同濃度的Na2S2O3溶液,再分別加入相同體積不同濃度的稀硫酸 | 研究濃度對反應速率的影響 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】NA代表阿伏加德羅常數的值。下列說法正確的是
A. 常溫常壓下,36g18O2中所含的中子數為16NA
B. 8.0 g Cu2S和CuO的混合物中含有的銅原子數為0.1NA
C. 電解飽和食鹽水時,陽極生成22.4L氣體時,轉移的電子數為2NA
D. 室溫下向1LpH=1的醋酸溶液中加水,所得溶液中H+數目小于0.1NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知化學反應A2(g)+B2(g)===2AB(g)的能量變化如圖所示,判斷下列敘述中正確的是

A. 每生成2分子AB吸收b kJ熱量
B. 該反應熱ΔH=+(a-b) kJ·mol-1
C. 該反應中反應物的總能量高于生成物的總能量
D. 斷裂1 mol A—A和1 mol B—B鍵,放出a kJ能量
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)寫出下列物質的電離方程式:① HCl=_____,② NaOH=___,③ NaCl =_______,④ H2SO![]() =____。
=____。
(2)選擇下列實驗方法分離物質,將分離方法的字母填在橫線上。
A.萃取分液法 B.加熱分解 C.結晶法 D.分液法 E.蒸餾法 F.過濾法
①________分離飽和食鹽水和沙子的混合物;
②________從硝酸鉀和氯化鈉的混合溶液中獲得硝酸鉀;
③________分離水和汽油的混合物;
④________分離四氯化碳(沸點為76.75 ℃)和甲苯(沸點為110.6 ℃)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知NaHSO3溶液顯酸性,溶液中存在以下平衡:HSO3-+H2O![]() H2SO3+OH- ① HSO3-
H2SO3+OH- ① HSO3-![]() H++SO32- ②向 0.1 mol·L-1的NaHSO3溶液中分別加入以下物質,下列有關說法正確的
H++SO32- ②向 0.1 mol·L-1的NaHSO3溶液中分別加入以下物質,下列有關說法正確的
A. 加入少量金屬 Na,平衡①左移,平衡②右移,溶液中 c(HSO3-)增大
B. 加入少量NaOH溶液,c(SO32-)/c(HSO3-)、c(OH-)/c(H+)的值均增大
C. 加入少量Na2SO3 固體,則 c(H+)+c(Na+)=c(HSO3-)+c(OH-)+1/2c(SO32-)
D. 加入氨水至中性,則 2c(Na+)=c(SO32-)>c(H+)=c(OH-)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將純鋅片和純銅片按圖示方式插入同濃度的稀硫酸中一段時間。以下敘述正確的是( )

A. 兩燒杯中銅片表面均有氣泡產生
B. 甲燒杯中的電流與陽離子流向均為Zn→Cu
C. 兩燒杯中溶液的pH均增大
D. 兩燒杯在相同時間內轉移電子數相等
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com