
| 元素編號 | 元素性質與原子(或分子)結構 |
| X | 周期表中原子半徑最小的元素 |
| T | 最外層電子數是次外層電子數的3倍 |
| Y | M層比K層少1個電子 |
| Z | 第三周期元素的金屬離子中半徑最小 |
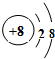 .
.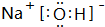 .
.分析 X是周期表中原子半徑最小的元素,則X為H元素;T的最外層電子數是次外層電子數的3倍,最外層電子數不能超過8,原子只能由2個電子層,最外層電子數為6,則T為O元素;Y原子的M層比K層少1個電子,則其M層電子數為1,故Y為Na;第三周期元素的金屬離子中Z的離子半徑最小,則Z為Al.
解答 解:X是周期表中原子半徑最小的元素,則X為H元素;T的最外層電子數是次外層電子數的3倍,最外層電子數不能超過8,原子只能由2個電子層,最外層電子數為6,則T為O元素;Y原子的M層比K層少1個電子,則其M層電子數為1,故Y為Na;第三周期元素的金屬離子中Z的離子半徑最小,則Z為Al.
(1)T為O元素,O2-離子結構示意圖為: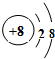 ,故答案為:
,故答案為: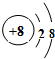 ;
;
(2)Na、Al同周期,隨核電荷數增大金屬性減弱,故Na的金屬性較強,
a.單質的熔點屬于物理性質,不能比較金屬性強弱,故a錯誤;
b.金屬性強弱與失去電子能與有關,與失去電子數目多少無關,即與化合價高低無關,故b錯誤;
c.金屬單質與水反應越劇烈,數目金屬性越強,故c正確;
d.金屬性越強,最高價氧化物對應的水化物的堿性越強,故d正確,
故答案為:Na;cd;
(3)由T、X、Y共同形成既有離子鍵又有共價鍵的化合物為NaOH,該化合物的電子式為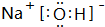 ,
,
故答案為: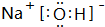 ;
;
(4)Z的氧化物為氧化鋁,Y的最高價氧化物的水化物為NaOH,二者反應生成偏鋁酸鈉與水,反應的離子方程式:Al2O3+2OH-=2AlO2-+H2O,
故答案為:Al2O3+2OH-=2AlO2-+H2O.
點評 本題考查結構性質物質關系應用,注意對元素周期律的理解掌握,掌握金屬性、非金屬性強弱比較實驗事實.


科目:高中化學 來源: 題型:選擇題
| A. | SiO2為分子晶體,Si為原子晶體 | |
| B. | Si是光導纖維的主要成分 | |
| C. | 在該反應條件下,C的氧化性強于Si的氧化性 | |
| D. | 每生成1 mol Si理論上轉移的電子數目約為4×6.02×1023 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 少量碳酸氫銨溶液與足量燒堿溶液混合加熱:NH4++OH-$\stackrel{△}{→}$NH3↑+H2O | |
| B. | 氨氣通入稀硫酸中:NH3+H+→NH4+ | |
| C. | 稀氨水與稀鹽酸混合:NH3?H2O+H+→NH4++H2O | |
| D. | 銅片溶于稀硝酸:3Cu+8H++2NO3-→3Cu2++2NO↑+4H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Cu (CuO),加鹽酸,過濾 | B. | NaCl (I2)固體,加熱升華 | ||
| C. | KNO3 (K2SO4),加BaCl2溶液,過濾 | D. | MgO (Al2O3),加燒堿溶液,過濾 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
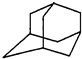 如圖是金剛烷的結構示意圖,1-溴金剛烷可用于合成甲型流感病毒的抑制劑.下列有關說法中正確的是( )
如圖是金剛烷的結構示意圖,1-溴金剛烷可用于合成甲型流感病毒的抑制劑.下列有關說法中正確的是( )| A. | 金剛烷的分子中有18個碳原子 | |
| B. | 1-溴金剛烷的結構有2種 | |
| C. | 金剛烷屬于烷烴的同系物 | |
| D. | 金剛烷應該具有和芳香烴相似的化學性質 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 常溫常壓下,36g18O2中所含的中子數為16NA | |
| B. | 8.0g Cu2S和CuO的混合物中含有銅原子數為0.1NA | |
| C. | 電解飽和食鹽水時,陽極上生成22.4L氣體時轉移的電子數為2NA | |
| D. | 標準狀況下,2.24 LCl2溶于水中達到飽和,可得到HClO分子的數目是0.1NA |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
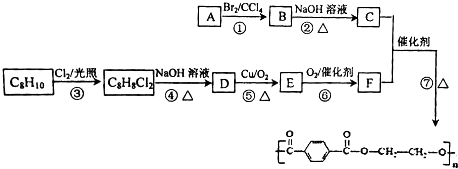
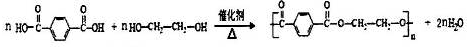
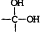 →
→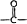 +H2O
+H2O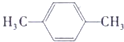 .
.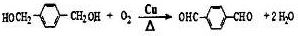 ;
; .
. .
.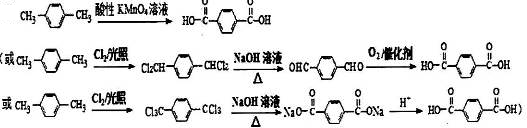 (有機物用結構簡式表示,無機試劑任選).
(有機物用結構簡式表示,無機試劑任選).查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com