
【題目】下列有關物質轉化關系的說法中不正確的是

A. 圖1中甲可能是Fe,X可能是Cl2
B. 圖2中A可能為F2,C可能為O2
C. 圖2中A可能為Ca(OH)2,C可能為NaOH
D. 圖3中a可能為C,b可能為CO,c可能為CO2
科目:高中化學 來源: 題型:
【題目】已知A~H均為中學化學常見的物質,轉化關系如下圖。其中A、C均為金屬單質,C與水反應生成D和最輕的氣體,D、F、G、H的焰色反應均為黃色,E為兩性化合物。

(1)寫出C與水反應的離子方程式_____________________________________,假設溫度不變,該反應會使水的電離程度________(填寫“變大”“變小”“不變”)
(2)B的水溶液呈_________性,用離子方程式解釋原因______________
(3)將A~H中易溶于水的化合物溶于水,會抑制水的電離的是____________(填序號)
(4)常溫下,pH均為10的D、F溶液中,水電離出的c(OH-)之比為___________________向D的稀溶液中通入CO2至溶液呈中性,所得溶液中離子物質的量濃度由大到小的順序為:_______________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】SO2的含量是衡量大氣污染的一個重要指標,工業上常采用催化還原法或吸收法處理SO2。利用催化還原SO2不僅可消除SO2污染,而且可得到有經濟價值的單質S。
(1)在復合組分催化劑作用下,CH4可使SO2轉化為S,同時生成CO2和H2O。
己知CH4和S的燃燒熱(△H)分別為-890.3 kJ /mol和-297.2 kJ /mol,則CH4和SO2反應的熱化學方程式為 _________________________________________________。
(2)用H2還原SO2生成S的反應分兩步完成,如圖1所示,該過程中相關物質的物質的量濃度隨時間的變化關系如圖2所示:
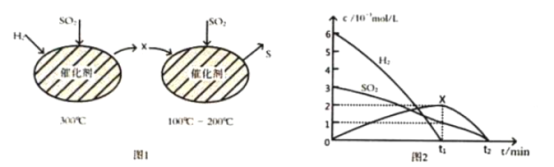
①分析可知X為________(寫化學式), 0~t1時間段的溫度為_____, 0~t1時間段用SO2表示的化學反應速率為 ___________________________。
②總反應的化學方程式為__________________________________________________________。
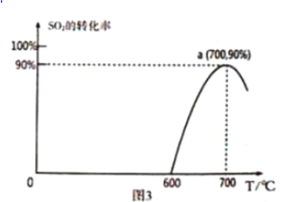
(3)焦炭催化還原SO2生成S2,化學方程式為:2C(s)+2SO2(g)![]() S2(g)+2CO2(g),恒容容器中,1 mol/LSO2與足量的焦炭反應,SO2的轉化率隨溫度的變化如圖3所示。
S2(g)+2CO2(g),恒容容器中,1 mol/LSO2與足量的焦炭反應,SO2的轉化率隨溫度的變化如圖3所示。
①該反應的△H _________________________ 0 (填“>”或“<”)
②計算700℃該反應的平衡常數為____________________ 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】亞硝酰氯(NOCl,熔點:-64.5 ℃,沸點:-5.5 ℃)是一種黃色氣體,遇水反應生成一種氯化物和兩種氮化物。可用于合成清潔劑、觸媒劑及中間體等。實驗室可由氯氣與一氧化氮在常溫常壓下合成。
(1)甲組的同學擬制備原料氣NO和Cl2,制備裝置如下圖所示:

①制備NO發生裝置可以選用___________________(填寫字母代號),請寫出發生反應的離子方程式:___________________。
②欲收集一瓶干燥的氯氣,選擇裝置,其連接順序為:a→ __________________(按氣流方向,用小寫字母表示)。
(2)乙組同學利用甲組制得的NO和Cl2制備NOCl,裝置如圖所示:


①實驗室也可用X裝置制備NO,X裝置的優點為________________________________。
②檢驗裝置氣密性并裝入藥品,打開K2,然后再打開 ____________,通入一段時間氣體,其目的為___________________________,然后進行其他操作,當Z有一定量液體生成時,停止實驗。
③若無裝置Y,則Z中NOCl可能發生反應的化學方程式為________________________。
④若尾氣處理裝置連接上圖燒杯中導管d,則燒杯中可加入 __________溶液。
(3)取Z中所得液體mg溶于水,配制成250mL溶液,取出25.00mL,以K2CrO4溶液為指示劑,用cmolL-1AgNO3標準溶液滴定至終點,消耗標準溶液的體積為22.50mL。則亞硝酰氯(NOC1)的質量分數為________(用代數式表示)。
[已知:Ag2CrO4為磚紅色固體;Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=1×10-12]
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在體積恒定的密閉容器中,一定量的SO2與1.100molO2在催化劑作用下加熱到600℃發生反應:2SO2+ O2![]() 2SO3,ΔH<0。當氣體的物質的量減少0.315mol時反應達到平衡,在相同溫度下測得氣體壓強為反應前的82.5%。下列有關敘述正確的是
2SO3,ΔH<0。當氣體的物質的量減少0.315mol時反應達到平衡,在相同溫度下測得氣體壓強為反應前的82.5%。下列有關敘述正確的是
A. 當SO3的生成速率與SO2的消耗速率相等時反應達到平衡
B. 降低溫度,正反應速率減小程度比逆反應速率減小程度大
C. 將平衡混合氣體通入過量BaCl2溶液中,得到沉淀的質量為161.980g
D. 達到平衡時,SO2的轉化率為90%
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列除雜的操作方法,正確的是( )
A.NH3中混有少量水蒸氣:通過裝有濃硫酸的洗氣瓶
B.NO中混有少量NO2氣體:用水洗滌后再干燥
C.食鹽中混有少量NH4Cl:加過量氫氧化鉀溶液后加熱蒸干
D.硝酸中混有少量硫酸:加適量BaCl2后再過濾
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】按要求寫出下列化學方程式或離子方程式:
(1)硫酸酸化的高錳酸鉀與草酸反應的化學方程式:_____________________________。
(2)硫代硫酸鈉與稀硫酸反應的化學方程式:____________________________________。
(3)硫酸酸化的碘化鉀溶液與氧氣反應的離子方程式:________________________。
(4)K2Cr2O7的溶液中K2Cr2O7與K2CrO4轉化的離子方程式:____________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】從精煉鋼的陽極泥中(主要成分為Cu2Te)回收碲的工藝流程如下:

請回答下列問題:
(1)“焙燒”后,碲主要以TeO2形式存在,則每生成32gTeO2,反應轉移電子的物質的量為____________mol。
(2)為選擇最佳焙燒工藝,進行溫度和硫酸加入量的條件試驗,結果如下表所示:

則實驗中應選擇的條件為________________________。
(3)“氧化”時的溶液溫度不宜過高,原因為________________________。
(4)工藝(I)中,“還原”時發生的總離子方程式為______________________________。H2SO4和Na2SO3可用濃鹽酸代替,但缺點為______________________________________。
(5)工藝(II)中,“浸出液電積”時產生碲粉的電極反應式為_______________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】I.某溫度時,在一個10L恒容容器中,X、Y、Z均為氣體,三種物質的物質的量隨時間的變化曲線如圖所示。根據圖中數據填空:

(1)該反應的化學方程式為_________________。
(2)反應開始至2min,以氣體X表示的平均反應速率為________________。
(3)平衡時容器內氣體的壓強與起始時比________________(填“變大”,“變小”或“相等”下同),混合氣體的密度與起始時比________________。
(4)將amolX與bmolY的混合氣體發生上述反應,反應到某時刻各物質的量恰好滿足:n(X)=n(Y)=2n(Z),則原混合氣體中a:b=____。
Ⅱ.在恒溫恒壓的密閉容器中,當下列物理量不再發生交化時:①混合氣體的壓強;②混合氣體的密度;③混合氣體的總物質的量;④混合氣體的平均相對分子質量;⑤各反應物或生成物的反應速率之比等于化學計量數之比
(1)一定能證明2NO2(g)![]() N2O4(g)達到平衡狀態的是________(填序號,下同)。
N2O4(g)達到平衡狀態的是________(填序號,下同)。
(2)一定能證明NH2COONH4(s)![]() CO2(g)+2NH3(g)達到平衡狀態的是______。
CO2(g)+2NH3(g)達到平衡狀態的是______。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com