
| A. |  AB2 | B. |  EF2 | C. |  XY3Z | D. |  AB3 |
分析 A.該晶胞中A離子個數是1、B離子個數=8×$\frac{1}{8}$=1;
B.該晶胞中E離子個數=F離子個數=4×$\frac{1}{8}$=$\frac{1}{2}$;
C.該晶胞中X離子個數是1、Y離子個數=6×$\frac{1}{2}$=3、Z離子個數8×$\frac{1}{8}$=1;
D.該晶胞中A離子個數=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4、B離子個數=1+12×$\frac{1}{4}$=4.
解答 解:A.該晶胞中A離子個數是1、B離子個數=8×$\frac{1}{8}$=1,A、B離子個數之比=1:1,其化學式為AB或BA,故A錯誤;
B.該晶胞中E離子個數=F離子個數=4×$\frac{1}{8}$=$\frac{1}{2}$,離子個數之比=$\frac{1}{2}$:$\frac{1}{2}$=1:1,化學式為EF或FE,故B錯誤;
C.該晶胞中X離子個數是1、Y離子個數=6×$\frac{1}{2}$=3、Z離子個數8×$\frac{1}{8}$=1,X、Y、Z離子個數之比=1:3:1,其化學式為 XY3Z,故C正確;
D.該晶胞中A離子個數=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4、B離子個數=1+12×$\frac{1}{4}$=4,A、B離子個數之比=4:4=1:1,其化學式為AB或BA,故D錯誤;
故選C.
點評 本題以晶胞計算為載體考查化學式判斷,側重考查學生計算及空間想象能力,明確每個離子被幾個晶胞占有是解本題關鍵,利用均攤法分析解答,題目難度不大.


 課時掌控隨堂練習系列答案
課時掌控隨堂練習系列答案 一課一練一本通系列答案
一課一練一本通系列答案 浙江之星學業水平測試系列答案
浙江之星學業水平測試系列答案科目:高中化學 來源: 題型:解答題

| 氫氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
| 開始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2[ | 5.4 |
| 沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 | 8.0 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 分子式為C3H6有機物最多存在4個C-C單鍵,與C4H10的碳碳單鍵數相同 | |
| B. | 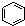 和 和 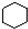 均是芳香烴, 均是芳香烴,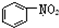 既是芳香烴又是芳香化合物 既是芳香烴又是芳香化合物 | |
| C. | 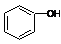 和 和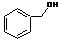 分子組成相差一個-CH2-,因此是同系物關系 分子組成相差一個-CH2-,因此是同系物關系 | |
| D. | 分子式為C2H6O的紅外光譜圖上發現有C-H鍵和C-O鍵的振動吸收,由此推測可能有H-O鍵 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 2px<2py<2p | B. | 2s<3s<4s z | C. | 3s<3p<3d | D. | 2px=2py=2pz |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
| Fe3+ | Al3+ | Fe2+ | Mg2+ | |
| 開始沉淀時 | 1.5 | 3.3 | 6.5 | 9.4 |
| 沉淀完全時 | 3.7 | 5.2 | 9.7 | 12.4 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 混合氣體的壓強 | B. | 混合氣體的密度 | ||
| C. | B物質的分子量 | D. | 氣體的總物質的量 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com