
| A. | 對于Si+O2═SiO2,每當新形成2NA個Si-O鍵,需要斷開NA個Si-Si鍵 | |
| B. | 12.0g熔融的NaHSO4中含有的陽離子數為0.1NA | |
| C. | 次氯酸光照分解產生22.4mL氣體(標準狀況)轉移的電子數為0.002NA | |
| D. | 電解精煉銅時,若陰極析出32g銅,則轉移的電子數為NA |
分析 A、1mol二氧化硅中含有4mol硅氧鍵,形成2NA個Si-O鍵,形成了0.5mol二氧化硅,需要0.5mol硅原子,再根據硅晶體的空間結構計算出需要斷裂Si-Si鍵數目;
B、熔融的NaHSO4中含有的陽離子只有鈉離子;
C、發生反應2HClO=2HCl+O2,產生的氣體為HCl、O2,根據n=$\frac{V}{Vm}$計算混合氣體的物質的量,進而計算氧氣的物質的量,反應中氧元素化合價由-2價升高為0價,據此計算轉移電子物質的量,再根據N=nNA計算轉移電子數目;
D、粗銅中含有雜質鐵、鋅等較活潑金屬,電解過程中鐵、鋅優先放電.
解答 解:A、對于Si+O2=SiO2,每當形成2NA個Si-O鍵,需要形成0.5mol二氧化硅,反應消耗了0.5mol硅原子;由于1mol硅原子形成了4個共價鍵,根據均攤法,1mol硅原子形成了2molSi-Si鍵,所以反應0.5mol硅需斷開1mol硅硅鍵,即斷裂NA個Si-Si鍵,故A正確;
B、12.0g熔融的NaHSO4的物質的量為0.1mol,0.1mol熔融硫酸氫鈉電離出0.1mol鈉離子和0.1mol硫酸氫根離子,所以含有的陽離子數為0.1NA,故B正確;
C、發生反應2HClO=2HCl+O2,產生的氣體為HCl、O2,生成混合氣體的物質的量為$\frac{0.0224L}{22.4L/mol}$=0.001mol,故生成氧氣的物質的量為0.001mol×$\frac{1}{3}$,反應中氧元素化合價由-2價升高為0價,故轉移電子數目為0.001mol×$\frac{1}{3}$×4×NAmol-1=0.0013NA,故C錯誤;
D、電解精煉銅時,陰極反應:Cu2++2e-=Cu,所以當陰極質量增重32g即析出0.5mol銅時,轉移的電子的物質的量為1mol,則陰極得到的電子數為NA,故D正確;
故選:C.
點評 本題考查了阿伏伽德羅常數的有關計算,熟練掌握公式的使用和物質的結構是解題關鍵,難度不大.


科目:高中化學 來源:2017屆江西省鷹潭市高三上學期第四次月考化學試卷 題型:選擇題
乙二酸(HOOC-COOH)與丁醇(C4H10O)存一定條件下反應,生成的二酯有
A.4種
B.6種
C.8種
D.10種
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
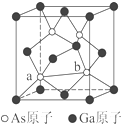 元素周期表第ⅤA族元素包括氮、磷、砷(As)、銻(Sb)等.這些元素無論在研制新型材料,還是在制作傳統化肥、農藥等方面都發揮了重要的作用.
元素周期表第ⅤA族元素包括氮、磷、砷(As)、銻(Sb)等.這些元素無論在研制新型材料,還是在制作傳統化肥、農藥等方面都發揮了重要的作用.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
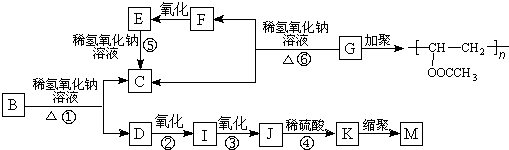
 .
. +3NaOH
+3NaOH CH3COONa+
CH3COONa+ +NaBr+H2O.
+NaBr+H2O.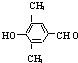 、
、 .
.查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 溶液的體積10V甲≤V乙 | |
| B. | 水電離出的OH-濃度:10c(OH-)甲≤c(OH-)乙 | |
| C. | 若分別與5 mL pH=11的NaOH溶液反應,所得溶液的pH:甲≤乙 | |
| D. | 若分別用等濃度的NaOH溶液完全中和,所得溶液的pH:甲≤乙 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

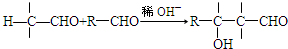

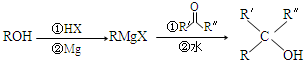
 .X與苯酚生成高聚物反應的化學方程式
.X與苯酚生成高聚物反應的化學方程式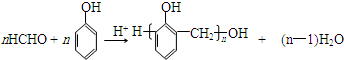 .
.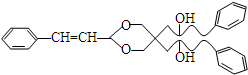 .
. .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
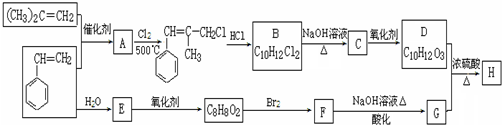
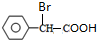 +2NaOH$\stackrel{△}{→}$
+2NaOH$\stackrel{△}{→}$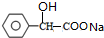 +NaBr+H2O.
+NaBr+H2O.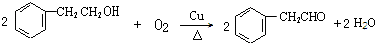 .
.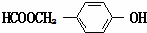 (寫結構簡式).
(寫結構簡式).查看答案和解析>>
科目:高中化學 來源: 題型:解答題
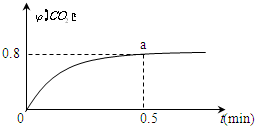 常溫下I2O5(s)可用于檢測CO,反應原理為:5CO(g)+I2O5(s)?5CO2(g)+I2(s)△H<0.一定溫度下,向2L恒容密閉容器中加入足量I2O5(s),并通入1molCO.反應中CO2的體積分數φ(CO2)隨時間的變化如圖所示:
常溫下I2O5(s)可用于檢測CO,反應原理為:5CO(g)+I2O5(s)?5CO2(g)+I2(s)△H<0.一定溫度下,向2L恒容密閉容器中加入足量I2O5(s),并通入1molCO.反應中CO2的體積分數φ(CO2)隨時間的變化如圖所示:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1,2,3三甲基苯 | B. | 丁烷 | C. | 異丙醇 | D. | 醋酸叔丁酯 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com