
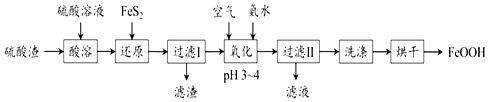
分析 硫酸渣(主要含Fe2O3、FeO,雜質為Al2O3和SiO2等)加硫酸溶解,金屬氧化物轉化為金屬陽離子,二氧化硅不溶,再加FeS2把鐵離子還原為Fe2+,同時生成S沉淀,過濾,濾渣含有二氧化硅和S、FeS2,濾液中含有Fe2+和Al3+,濾液中通入空氣氧化,同時調節pH生成FeOOH沉淀,過濾、洗滌、烘干,得到純凈的FeOOH;
(1)“酸溶”中硫酸要適當過量,目的是:①提高鐵的浸出率;②抑制Fe3+水解;
(2)氧化鐵是堿性氧化物,可以和酸反應生成鹽和水;
(3)由反應物和生成物以及電子守恒來配平化學方程式;根據流程分析判斷濾渣的主要成分;
(4)在堿性環境下,亞鐵離子可以被氧氣氧化為生成FeOOH;溫度過高,FeOOH分解生成Fe2O3;
(5)加氨水調節pH時,生成了硫酸銨.
解答 解:(1)“酸溶”中硫酸要適當過量,目的是:①提高鐵的浸出率;②抑制Fe3+水解;故答案為:抑制Fe3+水解;
(2)氧化鐵是堿性氧化物,可以和硫酸反應生成硫酸鐵和水,即Fe2O3+3H2SO4=Fe2(SO4)3+3H2O,
故答案為:Fe2O3+3H2SO4=Fe2(SO4)3+3H2O;
(3)由流程分析可知濾渣Ⅰ的主要成分是FeS2、S和SiO2;-2價的硫離子具有還原性,FeS2可以將溶液中的Fe3+還原為Fe2+,而本身被氧化為S沉淀,有關的離子方程式為2Fe3++FeS2=3Fe2++2S,
故答案為:2Fe3++FeS2=3Fe2++2S;SiO2;
(4)在堿性環境下,亞鐵離子可以被氧氣氧化為生成FeOOH,則“氧化”中,亞鐵離子、氧氣及氨水反應生成FeOOH、銨根離子和水,其離子方程式為4Fe2++8NH3•H2O+O2=4FeOOH↓+8NH4++2H2O,溫度過高,FeOOH分解生成Fe2O3而會導致產品顏色偏紅;
故答案為:4Fe2++8NH3•H2O+O2=4FeOOH↓+8NH4++2H2O;Fe2O3;
(5)濾液I中加氨水調節pH,會生成硫酸銨,所以濾液Ⅱ中溶質是Al2(SO4)3和 (NH4)2SO4;
故答案為:(NH4)2SO4.
點評 本題以鐵黃(FeOOH)的制備流程為知識背景,考查硅、鐵的化合物的性質、離子方程式的書寫、物質的分離提純等,難度中等,清楚工藝流程原理是解題的關鍵,是對知識遷移的綜合運用.


 開心試卷期末沖刺100分系列答案
開心試卷期末沖刺100分系列答案 雙基同步導航訓練系列答案
雙基同步導航訓練系列答案 黃岡小狀元同步計算天天練系列答案
黃岡小狀元同步計算天天練系列答案科目:高中化學 來源: 題型:選擇題
| A. | 氫氧化鎂溶于鹽酸:OH-+H+═H2O | |
| B. | 銅片插入硝酸銀溶液中:Cu+Ag+═Ag++Cu2+ | |
| C. | 將稀硫酸加入氫氧化鋇溶液:H++OH-═H2O | |
| D. | 碳酸鈉溶液與稀硫酸混合:CO32-+2H+═CO2↑+H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
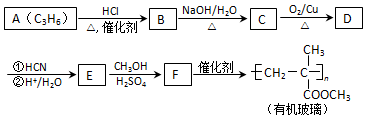
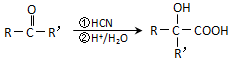 (注:R′可以是烴基,也可以是H原子)
(注:R′可以是烴基,也可以是H原子)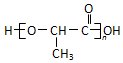 )是一種生物可降解材料,參考上述信息設計由乙醇制備聚乳酸的合成路線
)是一種生物可降解材料,參考上述信息設計由乙醇制備聚乳酸的合成路線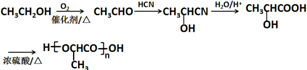 .(示例:反應條件X$\stackrel{反應條件1}{→}$Y$\stackrel{反應條件2}{→}$Z …)
.(示例:反應條件X$\stackrel{反應條件1}{→}$Y$\stackrel{反應條件2}{→}$Z …)查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 充電時陽極反應式為:Zn-2e-+2OH-=Zn(OH)2 | |
| B. | 0.1molK2FeO4發生反應,轉移電子數約為1.806×1024 | |
| C. | 充電時K2FeO4發生氧化反應 | |
| D. | 放電時正極反應為:2FeO42-+6e-+8H2O=2Fe(OH)3+10OH- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 分子式為C14H18O6 | B. | 含有羥基、羧基和苯基 | ||
| C. | 能發生取代反應 | D. | 能使溴的水溶液褪色 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 冬季燒煤炭供熱取暖與霧霾的形成無必然聯系 | |
| B. | 食品包裝袋中充人氮氣可防腐 | |
| C. | 鋼鐵表面鍍鋅可防止鐵的腐蝕 | |
| D. | 回收地溝油制造生物柴油符合環境保護的要求 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 有機物 | 氫氧化鈉 | 銀氨溶液 | 新制氫氧化銅 | 金屬鈉 |
| A | 發生中和反應 | 不反應 | 溶解 | 放出氫氣 |
| B | 不反應 | 發生銀鏡反應 | 生成紅色沉淀 | 放出氫氣 |
| C | 不反應 | 發生銀鏡反應 | 生成紅色沉淀 | 不反應 |
| D | 發生水解反應 | 不反應 | 不反應 | 不反應 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com