
【題目】某同學做同周期元素性質遞變規律實驗時,自己設計了一套實驗方案,并記錄了有關實驗現象如下表。
實驗方案 | 實驗現象 |
①用砂紙擦后的鎂帶與沸水反應,再向反應液中滴加酚酞 | A.浮于水面,熔成小球,在水面上無定向移動,隨之消失,溶液變成紅色 |
②向新制的H2S飽和溶液中滴加新制的氯水 | B.產生大量氣體,可在空氣中燃燒,溶液變成淺紅色 |
③鈉與滴有酚酞試液的冷水反應 | C.反應不十分強烈,產生的氣體可以在空氣中燃燒 |
④鎂帶與2mol·L-1的鹽酸反應 | D.劇烈反應,產生的氣體可以在空氣中燃燒 |
⑤鋁條與2mol·L-1的鹽酸反應 | E.生成白色膠狀沉淀,繼而沉淀消失 |
⑥向氯化鋁溶液中滴加氫氧化鈉溶液 | F.生成淡黃色沉淀 |
請你幫助該同學整理并完成實驗報告。
(1)實驗目的:______________________________________。
(2)實驗用品:儀器___________________等;藥品________________________等。
(3)實驗內容:(*填寫題給信息表中的序號)
實驗方案* | 實驗現象* | 有關化學方程式 |
_______________________________
(4)實驗結論:______________________________________。
(5)請從結構理論上簡單說明具有上述結論的原因___________________。
(6)請你補充一組實驗方案(簡單易行),證明此周期中另外兩種元素的性質遞變規律_____________________________________。
【答案】驗證第三周期元素從左至右金屬性遞減、非金屬性遞增的規律 試管,酒精燈,砂紙,鑷子,小刀,膠頭滴管等 鎂條,鈉,鋁條,新制氯水,新制飽和硫化氫溶液,2mol·L-1的鹽酸,NaOH溶液,蒸餾水,酚酞,AlCl3溶液
實驗方案 | 實驗現象 | 有關化學方程式 |
③ | A | 2Na+2H2O=2NaOH+H2↑ |
① | B | Mg+2H2O |
④ | D | Mg+2HCl=MgCl2+ H2↑ |
⑤ | C | 2Al+6HCl=2AlCl3+3H2↑ |
⑥ | E | AlCl3+3NaOH=Al(OH)3↓+NaCl Al(OH)3+NaOH=NaAlO2+2H2O |
② | F | H2S+Cl2=2HCl+S↓ |
金屬性:Na>Mg>Al;非金屬性:S<Cl 原子半徑隨電子數增多而減小,所以核對最外層電子的吸引力依次增強,原子失電子能力減弱,得電子能力增強 可向硅酸鈉溶液中滴加磷酸,有白色膠狀沉淀產生,表明磷酸酸性比硅酸酸性強,則磷的非金屬性比硅強(合理即可)
【解析】
(1)根據該同學做同周期元素性質遞變規律實驗,以及表中所使用的物質可知,實驗目的是:驗證第三周期元素從左至右金屬性遞減、非金屬性遞增的規律。
(2)根據實驗方案可以確定所需的儀器主要有:試管,酒精燈,砂紙,鑷子,小刀,膠頭滴管等;藥品有:鎂條,鈉,鋁條,新制氯水,新制飽和硫化氫溶液,2mol·L-1的鹽酸,NaOH溶液,蒸餾水,酚酞,AlCl3溶液。
(3)①Mg與沸水反應生成Mg(OH)2和H2,反應的化學方程式為Mg+2H2O![]() Mg(OH)2+H2↑,實驗現象為產生大量氣體,向反應液中滴加酚酞,溶液變成淺紅色,選B;
Mg(OH)2+H2↑,實驗現象為產生大量氣體,向反應液中滴加酚酞,溶液變成淺紅色,選B;
②向新制的H2S飽和溶液中滴加新制氯水,發生反應Cl2+H2S=S↓+2HCl,實驗現象為生成淡黃色沉淀,選F;
③Na與冷水反應生成NaOH和H2,反應的方程式為2Na+2H2O=2NaOH+H2↑,實驗現象為:Na浮于水面,熔成小球,在水面上無定向移動,隨之消失,溶液變成紅色,選A;
④Mg與鹽酸反應生成MgCl2和H2,反應方程式為Mg+2HCl=MgCl2+H2↑,實驗現象為:Mg劇烈反應,產生的氣體可以在空氣中燃燒,選D;
⑤Al與鹽酸反應生成AlCl3和H2,反應的方程式為2Al+6HCl=2AlCl3+3H2↑,實驗現象為:反應不十分強烈,產生的氣體可以在空氣中燃燒,選C;
⑥向氯化鋁溶液中滴加NaOH溶液,隨著NaOH溶液的滴入,依次發生反應AlCl3+3NaOH=Al(OH)3↓+3NaCl、Al(OH)3+NaOH=NaAlO2+2H2O,實驗現象為:生成白色膠狀沉淀,繼而沉淀消失,選E;
據以上分析填寫表格。
(4)根據實驗①③,說明與水反應時Na比Mg劇烈,說明Na的金屬性強于Mg;根據實驗④⑤,說明與同濃度的鹽酸反應時Mg比Al劇烈,說明Mg的金屬性強于Al;根據實驗⑥,說明Al(OH)3屬于兩性氫氧化物,結合①中加入酚酞后溶液呈淺紅色,說明堿性Mg(OH)2> Al(OH)3,也說明Mg的金屬性強于Al;根據實驗②說明Cl的非金屬性強于S;則實驗結論:金屬性:Na>Mg>Al;非金屬性:S<Cl。
(5)從結構上解釋:Na、Mg、Al、S、Cl原子都有3個電子層,但原子半徑隨電子數增多而減小,所以核對最外層電子的吸引力依次增強,原子失電子能力減弱,得電子能力增強。
(6)第三周期中還有Si、P兩種非金屬元素,要證明非金屬性的強弱可依據“非金屬單質與H2化合的難易、氣態氫化物的穩定性、最高價氧化物對應水化物酸性的強弱”判斷,故實驗方案為:可向硅酸鈉溶液中滴加磷酸,有白色膠狀沉淀產生,表明磷酸酸性比硅酸酸性強,則磷的非金屬性比硅強(合理即可)。


 世紀百通期末金卷系列答案
世紀百通期末金卷系列答案科目:高中化學 來源: 題型:
【題目】25 ℃時,下列有關溶液中微粒的物質的量濃度關系正確的是( )
A.0.1 mol·L-1 CH3COONa溶液與0.1 mol·L-1 HCl溶液等體積混合:c(Na+)=c(Cl-)>c(CH3COO-)>c(OH-)
B.0.1 mol·L-1 NH4Cl溶液與0.1 mol·L-1氨水等體積混合(pH>7):c(NH3·H2O)>c(NH![]() )>c(Cl-)>c(OH-)
)>c(Cl-)>c(OH-)
C.0.1 mol·L-1 Na2CO3溶液與0.1 mol·L-1 NaHCO3溶液等體積混合:![]() c(Na+)=c(CO
c(Na+)=c(CO![]() )+c(HCO
)+c(HCO![]() )+c(H2CO3)
)+c(H2CO3)
D.0.1 mol·L-1 Na2C2O4溶液與0.1 mol·L-1 HCl溶液等體積混合(H2C2O4為二元弱酸):2c(C2O![]() )+c(HC2O
)+c(HC2O![]() )+c(OH-)=c(Na+)+c(H+)
)+c(OH-)=c(Na+)+c(H+)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,用0.1mol/LNaOH溶液分別滴定20mL濃度均為0.10mol/L的CH3COOH溶液和HCN溶液,所得滴定曲線如圖所示。已知:CH3COOH的Ka=1.75×10-5,HCN的Ka=4.9×10-10。下列說法正確的是( )
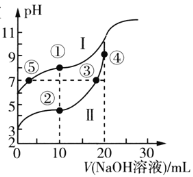
A.點①與點②對應的溶液中:c(CH3COO-)>c(CN-)
B.點②對應的溶液中:c(Na+)+c(H+)=c(CN-)+C(OH-)
C.點③和點⑤對應的溶液中:c(CH3COO-)-c(CN-)=c(HCN)-c(CH3COOH)
D.點④對應的溶液中:c(OH-)=c(H+)+c(CH3CO0H)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】溫度為T時,向2 L的密閉容器中充入一定量的A和B,發生反應:A(g)+B(g)![]() C(g)+xD(g) ΔH>0,容器中A、B、D的物質的量隨時間的變化如圖所示。下列說法正確的是( )
C(g)+xD(g) ΔH>0,容器中A、B、D的物質的量隨時間的變化如圖所示。下列說法正確的是( )

A.反應前10 min內反應的平均速率為v(D)=0.3 mol·L-1·min-1
B.若平衡時保持溫度不變,壓縮容器體積,平衡逆向移動,平衡常數K值減小
C.反應至15 min時,其他條件不變,改變的條件可能是縮小容器體積
D.反應至15 min時,其他條件不變,改變的條件可能是降低反應體系溫度
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定條件下,下列反應中水蒸氣含量隨反應時間的變化趨勢符合題圖10 的是

A. CO2(g)+2NH3(g)![]() CO(NH2)2(s)+H2O(g);△H<0
CO(NH2)2(s)+H2O(g);△H<0
B. CO2(g)+H2(g)![]() CO(g)+H2O(g);△H>0
CO(g)+H2O(g);△H>0
C. CH3CH2OH (g)![]() CH2=CH2(g)+H2O(g);△H>0
CH2=CH2(g)+H2O(g);△H>0
D. 2C6H5CH2CH3(g)+O2(g)![]() 2 C6H5CH=CH2(g)+2H2O(g);△H<0
2 C6H5CH=CH2(g)+2H2O(g);△H<0
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】由硫鐵礦燒渣(主要成分:Fe2O3、Al2O3、FeO、SiO2)制備綠礬(FeSO47H2O)的流程如下:

已知:①FeS2難溶于水,能還原Fe3+,硫元素被氧化成SO42-。
②金屬離子生成氫氧化物沉淀的pH范圍見下表:
金屬離子 | 開始沉淀的pH | 沉淀完全的pH |
Fe3+ | 1.5 | 3.2 |
Al3+ | 3.0 | 5.0 |
Fe2+ | 6.3 | 8.3 |
(1)濾渣Ⅰ的主要成分可與某種酸反應,其氣態產物的電子式為____________;濾渣Ⅱ經灼燒后可用于_______(寫出一種用途即可)。
(2)“還原”的目的是__________,寫出“還原”步驟中涉及反應的離子方程式_________。
(3)“除鋁”反應過程中控制的pH范圍是_______________________。
(4)操作Ⅲ包含3個基本的實驗操作,依次是_______________,“洗滌”時的試劑最好選用下列中的____________(填代號)
A.熱水 B.氯水 C.乙醇 D.飽和食鹽水
(5)設計實驗檢驗制得的綠礬晶體中是否含有Fe3+:___________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】我國科研人員提出了由CO2和CH4轉化為高附加值產品CH3COOH的催化反應歷程。該歷程示意圖如圖:
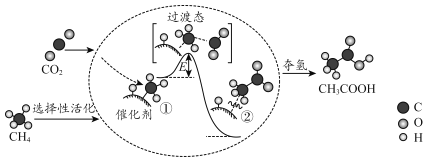
下列說法不正確的是( )
A.①→②放出能量
B.①→②中形成碳碳鍵
C.①→②中碳氫鍵發生斷裂
D.由②得到乙酸的過程中,形成了氧氫鍵
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A是由導熱材料制成的密閉容器,B是一耐化學腐蝕且易于傳熱的氣球.關閉K2,將等量且少量的NO2通過K1、K3分別充入A、B中,反應起始時,A、B的體積相同.(已知:2NO2(g) ![]() N2O4(g) ΔH<0)
N2O4(g) ΔH<0)
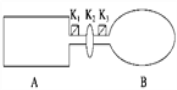
(1)一段時間后,反應達到平衡,此時A、B中生成N2O4的速率是vA______vB(填“>”、“<”或“=”);若打開活塞K2,氣球B將______(填“變大”、“變小”或“不變”).
(2)關閉活塞K2,若在A、B中再充入與初始量相等的NO2,則達到平衡時,NO2的轉化率αA將________(填“增大”、“減小”或“不變”);若分別通入等量的氖氣,則達到平衡時,A中NO2的轉化率將________,B中NO2的轉化率將______(填“變大”、“變小”或“不變”).
(3)室溫下,若A、B都保持體積不變,將A套上一個絕熱層,B與外界可以進行熱傳遞,則達到平衡時,______中的顏色較深.
(4)若在容器A中充入4.6 g的NO2,達到平衡后容器內混合氣體的平均相對分子質量為57.5,則平衡時N2O4的物質的量為___________________.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】利用I2O5可消除CO污染或定量測定CO,反應為:
5CO(g)+I2O5(s)5CO2(g)+I2(s);△H1
(1)已知:2CO(g)+O2(g)2CO2(g);△H2
2I2(s)+5O2(g)2I2O5(s);△H3
則△H1=____________________(用含△H2和△H3的代數式表示).
(2)不同溫度下,向裝有足量I2O5固體的1L恒容密閉容器中通入1molCO,測得CO2的濃度c(CO2)隨時間t變化曲線如圖.請回答:

①從反應開始至a點時的反應速率為v(CO)=______________,b點時化學平衡常數Kb=______.
②d點時,溫度不變,若將容器體積壓縮至原來的一半,請在圖中補充畫出CO2體積分數的變化曲線_________.
③下列說法正確的是_____.(填字母序號)
A.容器內氣體密度不變,表明反應達到平衡狀態
B.兩種溫度下,c點時體系中混合氣體的平均相對分子質量相等
C.增加I2O5的投料量有利于提高CO的轉化率
D.b點和d點的化學平衡常數:Kb<Kd.
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com