
| 實驗序號 | 樣品的質量/g | NaOH溶液的體積/mL | 氨氣的體積/L |
| Ⅰ | 7.4 | 40.00 | 1.68 |
| Ⅱ | 14.8 | 40.00 | 3.36 |
| Ⅲ | 22.2 | 40.00 | 1.12 |
| Ⅳ | 37.0 | 40.00 | 0 |
分析 (1)(NH4)2SO4和NH4HSO4固體混合物中加入氫氧化鈉溶液,首先氫離子與氫氧化鈉溶液發生中和反應,然后銨根離子與氫氧根離子加熱反應生成氨氣,據此寫出反應的離子方程式;
(2)由數據Ⅰ和Ⅱ判斷此時氫氧化鈉過量,樣品步驟,生成氨氣的體積與樣品的質量成正比,據此計算出3.7g樣品生成氨氣的體積;
(3)Ⅱ中樣品完全反應,設出(NH4)2SO4和NH4HSO4的物質的量,然后根據氨氣的物質的量、樣品質量列式計算出二者的物質的量,再計算出二者的物質的量之比;
(4)根據Ⅲ組數據中進入22.2g樣品只生成了1.12L氨氣可知,此時氫氧化鈉溶液不足,可以根據Ⅲ中數據計算出氫氧化鈉溶液濃度;
先根據(3)計算出22.2g樣品中含有的NH4HSO4物質的量,再根據反應的先后順序H++OH-=H2O,NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O計算出氫氧化鈉的物質的量,最后根據c=$\frac{n}{V}$計算出氫氧化鈉的物質的量濃度.
解答 解:(1)(NH4)2SO4和NH4HSO4固體混合物中加入氫氧化鈉溶液后加熱發生的反應有:氫離子與氫氧根離子反應生成水:H++OH-=H2O、銨根離子與氫氧根離子在加熱條件下反應生成氨氣:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O,
故答案為:H++OH-=H2O、NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O;
(2)由Ⅰ和Ⅱ中的數據7.4 g:1.68 L=14.8 g:3.36 L可知:當樣品質量≤14.8 g時,NaOH足量,即樣品質量與氨氣體積比為定值,則3.7g樣品生成氨氣的體積為:V(NH3)=$\frac{3.7g}{7.4g}$×1.68 L=0.84 L,
故答案為:0.84;
(3)設 (NH4)2SO4、NH4HSO4物質的量分別為x、y,則:①2x+y=$\frac{1.68L}{22.4L/mol}$=0.075mol,②132x+115y=7.4g,
根據①②聯立解得:$\left\{\begin{array}{l}{x=0.0125mol}\\{y=0.05mol}\end{array}\right.$,
所以:n[(NH4)2SO4]:n[NH4HSO4]=0.0125mol:0.05mol=1:4,
故答案為:1:4;
(4)根據表中數據可知,當Ⅲ中進入22.2g樣品時,比Ⅱ生成的氨氣體積小,說明氫氧化鈉已經不足,可以根據Ⅲ計算出氫氧化鈉溶液的濃度;
根據(3)可知,22.2g樣品中含NH4HSO4物質的量為:0.05mol×$\frac{22.2g}{7.4g}$=0.15mol,反應的先后順序為:H++OH-→H2O,NH4++OH- $\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O,
求得n(NaOH)=0.15mol+$\frac{1.12L}{22.4L/mol}$=0.2mol,
則氫氧化鈉溶液的濃度為:c(NaOH)=$\frac{0.2mol}{0.04L}$=5mol/L,
故答案為:Ⅲ;22.2g樣品中含NH4HSO4物質的量為:0.05mol×$\frac{22.2g}{7.4g}$=0.15mol,反應的先后順序為:H++OH-→H2O,NH4++OH- $\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O,
求得n(NaOH)=0.15mol+$\frac{1.12L}{22.4L/mol}$=0.2mol,
則氫氧化鈉溶液的濃度為:c(NaOH)=$\frac{0.2mol}{0.04L}$=5mol/L.
點評 本題考查了有關混合物的計算,題目難度較大,正確分析表中數據不能夠判斷過量情況為解答關鍵,注意掌握常見物質之間的反應原理,試題充分考查了學生的分析、理解能力及化學計算能力.


 世紀百通期末金卷系列答案
世紀百通期末金卷系列答案科目:高中化學 來源: 題型:選擇題

| 選項 | 操作1 | 操作2 | 操作3 | 操作4 |
| A | 溶解 | 結晶 | 蒸發 | 過濾 |
| B | 蒸發 | 過濾 | 冷卻 | 過濾 |
| C | 蒸發 | 結晶 | 結晶 | 蒸發 |
| D | 過濾 | 結晶 | 冷卻 | 結晶 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
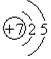
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | NH4Cl的電子式: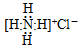 | |
| B. | 對硝基甲苯: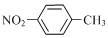 | |
| C. | 碳酸的電離方程式:H2CO3?2H++CO${\;}_{3}^{2-}$ | |
| D. | 硫離子的結構示意圖: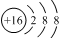 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 鉀石墨是一類共價化合物 | B. | 鉀石墨導電性比石墨強 | ||
| C. | 鉀石墨遇水不產生氫氣 | D. | C8K、C24K和C36K屬于同素異形體 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 如圖表示各物質間的轉化關系.已知A、H為離子化合物,H晶體中陰、陽離子的個數比為2:1,常用作干燥劑,D、E為單質.
如圖表示各物質間的轉化關系.已知A、H為離子化合物,H晶體中陰、陽離子的個數比為2:1,常用作干燥劑,D、E為單質.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 常溫時,某溶液中由水電離出來的c(H+)和c(OH-)的乘積為l×10-24,該溶液中一定可以大量存在K+、Na+、AlO-2、SO2-4 | |
| B. | 1 mol Na2O和Na2O2混合物中含有的陰、陽離子總數是3NA | |
| C. | 鎳鎘可充電電池在現代生活中有廣泛應用,它的充放電反應按下式進行:Cd(OH)2+2Ni(OH)2$?_{放電}^{充電}$Cd(OH)2+2Ni(OH)2+2H2O,充電時陽極反應為:Ni(OH)2+OH-+e-═NiO(OH)+H2O | |
| D. | 某一反應體系中的物質有:HCl、SnCl2、H2SnCl6、As、H3AsO3、H2O.已知As是產物之一,則該反應配平后H2O的化學計量數為6 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
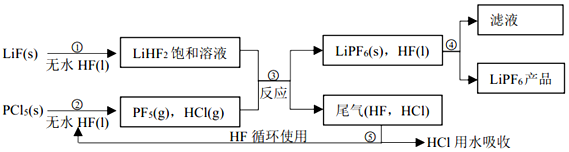
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
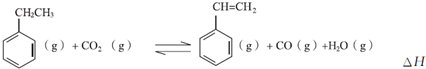
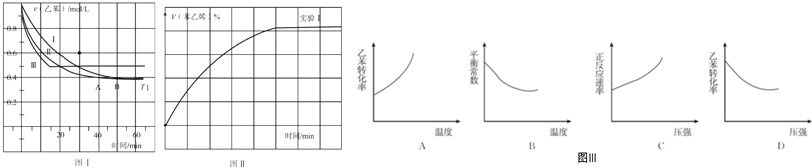

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com