
 氫氧化鈉溶液 | 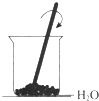 Ba(OH)2+H2O+NH4Cl | 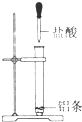 | 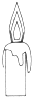 蠟燭燃燒 |
| A | B | C | D |
| A. | A | B. | B | C. | C | D. | D |
分析 常見的放熱反應有:所有的物質燃燒、所有金屬與酸或與水、所有中和反應、絕大多數化合反應、鋁熱反應;
常見的吸熱反應有:絕大數分解反應、個別的化合反應(如C和CO2)、工業制水煤氣、碳(一氧化碳、氫氣)還原金屬氧化物、某些復分解(如銨鹽和強堿).
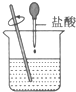
解答 解:A、酸堿中和為放熱反應,故鹽酸和氫氧化鈉的反應為放熱反應,故A錯誤;
B、銨鹽和強堿的反應為吸熱反應,故Ba(OH)2•8H2O和NH4Cl的反應吸熱,故B正確;
C、金屬和鹽酸的反應為放熱反應,故鋁條和鹽酸的反應為放熱反應,故C錯誤;
D、物質的燃燒一定為放熱反應,故蠟燭的燃燒放熱,故D錯誤.
故選B.
點評 本題考查化學反應中能量變化,題目難度不大,掌握常見的放熱反應和吸熱反應是解題的關鍵.


科目:高中化學 來源: 題型:解答題
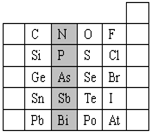 元素在周期表中的位置,反映了元素的原子結構和元素的性質.如圖是元素周期表的一部分.
元素在周期表中的位置,反映了元素的原子結構和元素的性質.如圖是元素周期表的一部分.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Mg2+、Na+、Cl-、SO42- | B. | K+、Na+、Cl-、AlO2- | ||
| C. | Cu2+、Ca2+、Br-、I- | D. | Ba2+、K+、Cl-、HCO3- |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
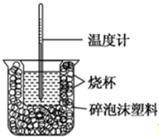
| 反應物 | 起始溫度t1/℃ | 終止溫度t2/℃ | 中和熱 |
| HCl+NaOH | 13 | 19.8 | △H1 |
| HCl+NH3•H2O | 13 | 19.3 | △H2 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 如圖是以Zn和Cu為電極,稀H2SO4為電解質溶液形成的原電池,某實驗興趣小組做完實驗后,在讀書卡片上記錄如下:
如圖是以Zn和Cu為電極,稀H2SO4為電解質溶液形成的原電池,某實驗興趣小組做完實驗后,在讀書卡片上記錄如下:| ①Zn為正極,Cu為負極; ②H+向負極移動; ③Cu極有H2產生; ④電子流動方向Zn→G→Cu; ⑤正極的電極反應式是Zn-2e-=Zn2+: ⑥若有1mol電子流過導線,則理論上產生0.5mol H2. |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
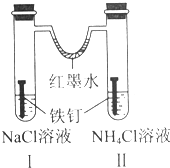
| A. | 紅墨水水柱兩邊的液面變為左低右高 | |
| B. | Ⅰ和Ⅱ中負極反應式均為Fe-2e-=Fe2+ | |
| C. | Ⅰ中正極反應式為O2+2H2O+4e-=4OH- | |
| D. | Ⅱ中加入少量K3[Fe(CN)6]溶液,生成藍色沉淀 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 標準狀況下,反應過程中得到6.72L的氣體 | |
| B. | 最終得到7.8g沉淀 | |
| C. | 最終得到的溶液中只含NaCl溶質 | |
| D. | 最終得到的溶液中c(Na+)=1.5mol/L |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com