
| 300℃ | K2O.N2 |
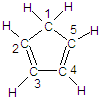 (圖中數字僅代表碳原子編號),在其5個碳原子中采取sp3雜化的是
(圖中數字僅代表碳原子編號),在其5個碳原子中采取sp3雜化的是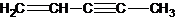 是環茂二烯的一種同分異構體,在其分子結構中處于同一平面上的原子個數最多有
是環茂二烯的一種同分異構體,在其分子結構中處于同一平面上的原子個數最多有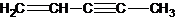 中處于同一平面上的原子個數最多有9個,故答案為:1;9;
中處于同一平面上的原子個數最多有9個,故答案為:1;9;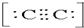 2-,故答案為:C22-;
2-,故答案為:C22-;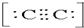 2-.
2-.

 新題型全程檢測期末沖刺100分系列答案
新題型全程檢測期末沖刺100分系列答案科目:高中化學 來源: 題型:閱讀理解
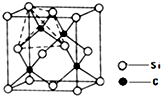 (2013?青島一模)[化學-物質結構與性質]
(2013?青島一模)[化學-物質結構與性質]查看答案和解析>>
科目:高中化學 來源: 題型:
| I1 | I2 | I3 | I4 | … |
| 496 | 4562 | 6912 | 9540 | … |
查看答案和解析>>
科目:高中化學 來源: 題型:
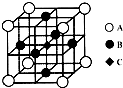 (2013?南通一模)【物質結構與性質】
(2013?南通一模)【物質結構與性質】



查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解

| 氟化物 | AF | BF2 | DF4 |
| 熔點/K | 1266 | 1534 | 183 |
| 1 |
| 2 |
| 3 |
| 2 |
查看答案和解析>>
科目:高中化學 來源: 題型:
 (2011?鄭州二模)[化學--選修物質結構與性質]
(2011?鄭州二模)[化學--選修物質結構與性質]查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com