

 .
. ,
, .
.分析 由元素在周期表中位置,可知a為H、b為C、c為N、d為O、e為Na、f為Al、g為Si、h為P、i為S、j為Cl.
(1)上述元素中Na的金屬性最強,故NaOH堿性最強;c元素10電子的氫化物為NH3,分子中N原子與H原子之間形成1對共用電子對;
(2)Na2O2由鈉離子與過氧根離子構成,過氧根離子中氧原子之間形成1對共用電子對,帶2個單位負電荷;
(3)CO2屬于共價化合物,分子中C原子與氧原子之間形成2對共用電子對,用C原子、O原子電子式表示其形成;
(4)氫氣、氧氣、KOH溶液構成燃料電池,正極發生還原反應,氧氣在正極獲得電子,堿性條件下生成氫氧根離子,本質是氫氣燃燒生成水,溶液中OH-離子濃度減小,堿性減弱;根據H元素化合價變化計算轉移電子;
(5)水分子之間存在氫鍵,沸點高于硫化氫;
(6)表中兩種元素的原子按1:1組成的常見液態化合物為H2O2,在MnO2或FeCl3催化作用下分解,而Na2SO3具有還原性,與H2O2發生氧化還原反應,硫酸鉀不能催化H2O2分解;
(7)根據質量分數確定分子中C、H原子數目之比,進而確定最簡式,再結合相對分子質量確定分子式.
解答 解:由元素在周期表中位置,可知a為H、b為C、c為N、d為O、e為Na、f為Al、g為Si、h為P、i為S、j為Cl.
(1)上述元素中Na的金屬性最強,故NaOH堿性最強,含有離子鍵、共價鍵;c元素10電子的氫化物為NH3,分子中N原子與H原子之間形成1對共用電子對,結構式為 ,
,
故答案為:NaOH;離子鍵、共價鍵; ;
;
(2)Na2O2由鈉離子與過氧根離子構成,過氧根離子中氧原子之間形成1對共用電子對,帶2個單位負電荷,電子式為: ,故答案為:
,故答案為: ;
;
(3)CO2屬于共價化合物,分子中C原子與氧原子之間形成2對共用電子對,用C原子、O原子電子式表示其形成為: ,
,
故答案為: ;
;
(4)氫氣、氧氣、KOH溶液構成燃料電池,正極發生還原反應,氧氣在正極獲得電子,堿性條件下生成氫氧根離子,正極電極反應式為:O2+2H2O+4e-═4OH-,本質是氫氣燃燒生成水,溶液中OH-離子濃度減小,堿性減弱,溶液pH減小;氫氣物質的量為$\frac{2.24L}{22.4L/mol}$=0.1mol,故轉移電子為0.1mol×2×6.02×1023mol-1=1.204×1023,
故答案為:O2+2H2O+4e-═4OH-;減小;1.204×1023;
(5)水分子之間存在氫鍵,而硫化氫分子之間為范德華力,氫鍵比范德華力更強,故水的沸點高于硫化氫,
故答案為:H2O;H2O分子間存在氫鍵;
(6)兩種元素的原子按1:1組成的常見液態化合物為H2O2,在MnO2或FeCl3催化作用下分解,而Na2SO3具有還原性,與H2O2發生氧化還原反應,不能用作催化劑,硫酸鉀不能催化H2O2分解,
故答案為:AB;
(7)由C、H形成的一種化合物,其相對分子質量在30~50之間,且碳的質量分數為$\frac{6}{7}$,則化合物中C、H原子數目之比為$\frac{\frac{6}{7}}{12}$:$\frac{1-\frac{6}{7}}{1}$=1:2,最簡式為CH2,令分子式為(CH2)x,則30<14x<50,故x=3,該化合物分子式為:C3H6,
故答案為:C3H6.
點評 本題考查元素周期表與元素周期律綜合應用,是對學生綜合能力的考查,學習中注意積累相關知識,注意用電子式表示化學鍵或物質的形成過程.


 學練快車道快樂假期暑假作業新疆人民出版社系列答案
學練快車道快樂假期暑假作業新疆人民出版社系列答案 浙大優學小學年級銜接導與練浙江大學出版社系列答案
浙大優學小學年級銜接導與練浙江大學出版社系列答案 小學暑假作業東南大學出版社系列答案
小學暑假作業東南大學出版社系列答案 津橋教育暑假拔高銜接廣東人民出版社系列答案
津橋教育暑假拔高銜接廣東人民出版社系列答案 波波熊暑假作業江西人民出版社系列答案
波波熊暑假作業江西人民出版社系列答案科目:高中化學 來源: 題型:解答題
 氫能的研究和利用是當今科學研究的熱點之一,而尋找性能優越,安全性高、價格低廉、環保的儲氫
氫能的研究和利用是當今科學研究的熱點之一,而尋找性能優越,安全性高、價格低廉、環保的儲氫
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 0.4mol | B. | 0.2mol | C. | 0.2mol<x<0.4mol | D. | <0.2mol |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 可逆反應aA(g)+bB(g)?cC(g)+dD(g)的v-t圖象如圖所示.
可逆反應aA(g)+bB(g)?cC(g)+dD(g)的v-t圖象如圖所示.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Li、Na、K元素的原子核外電子層數隨著核電荷數的增加而減少 | |
| B. | 因為K比Na容易失去電子,所以K比Na的還原性強 | |
| C. | 第二周期元素從Li到F,非金屬性逐漸減弱 | |
| D. | O與S為同主族元素,且O比S的非金屬性弱 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
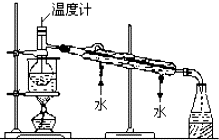 海洋植物如海帶中含有豐富的碘元素,碘元素以碘離子的形式存在.某研究性學習小組設計如下實驗從海帶中提取碘,請你完成下面相關問題:
海洋植物如海帶中含有豐富的碘元素,碘元素以碘離子的形式存在.某研究性學習小組設計如下實驗從海帶中提取碘,請你完成下面相關問題:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 鎂和鹽酸反應:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 氯化鐵溶液中加入銅片:Fe3++Cu═Fe2++Cu2+ | |
| C. | 氯氣通入水中:CI2+H2O═2H++CI-+CIO- | |
| D. | 硫酸溶液中加入氫氧化鋇溶液:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 選項 | 實驗目的 | 實驗方案 |
| A | 驗證Br2的氧化性強于l2 | 將少量溴水加入Kl溶液中,再加入CCl4,振蕩,靜置,可觀察到下層液體呈紫色 |
| B | 探究石蠟油分解的產物含有烯烴 | 將石蠟油加強熱產生的氣體通入溴的四氧化碳溶液中 |
| C | 探究蔗糖水解的產物中是否含有葡萄糖 | 取少量蔗糖溶液加稀硫酸,水溶加熱幾分鐘后,再加入新制的氫氧化銅懸濁液并加熱 |
| D | 驗證Na能置換出醇烴基中的氫 | 向一定量的無水乙醇中加入足量Na,測量生成氣體的體積 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com