
(10分)下表為元素周期表的一部分,所標的字母各代表一種化學元素。
試回答下列問題:
(1)元素M在第________周期第________族。
(2)C的10電子氫化物的電子________,D的簡單氫化物的空間結構為________________。
(3)試寫出一種由上述3種元素組成的不含有金屬元素的離子化臺物____________(填化學式)。
(4)上述元素中非金屬性最強的元素是_____________(填元素符號),元素最高價氧化物對應水化物酸性最強的物質是_____________(填化學式)。
(5)寫出G與I的最高價氧化物對應水化物反應的離子方程式:____________________
(1)第四周期第VIB族;
(2) ;三角錐型;
;三角錐型;
(3)NH4Cl或NH4F;
(4)F;HClO4;
(5)Al(OH)3+OH-=AlO-2+2H2O。
解析試題分析:(1)根據元素周期表的結構判斷元素M的位置是第四周期第VIB族;
(2)C為C元素,10電子的氫化物是CH4,其電子式為 ;D是N元素,其氫化物是氨氣,分子空間構型是三角錐型;
;D是N元素,其氫化物是氨氣,分子空間構型是三角錐型;
(3)不含有金屬元素的離子化臺物一般是銨鹽,從表中可判斷該化合物是NH4Cl或NH4F;
(4)元素非金屬性最強的位于元素周期表的最右上角位置,是F元素;F無正價,所以元素最高價氧化物對應水化物酸性最強的物質Cl元素對應的最高價含氧酸是HClO4;
(5)G與I分別是Na、Al元素,最高價氧化物的水化物分別是NaOH、Al(OH)3,二者反應的離子方程式為Al(OH)3+OH-=AlO-2+2H2O。
考點:考查元素周期表的應用,元素及其化合物的性質,化學式、電子式、離子方程式的書寫


 沖刺100分1號卷系列答案
沖刺100分1號卷系列答案科目:高中化學 來源: 題型:填空題
(每空1分,共6分)
A、B、C、D、E、F為六種短周期主族元素,它們的原子序數依次增大;A元素的原子半徑最小;B元素原子的最外層電子數是次外層電子數的3倍;C與A同主族,且與E同周期;E元素的最外層電子數是次外層電子數的0.75倍,D既可與C的最高價氧化物的水化物反應,也可與E的最高價氧化物的水化物反應,均有A元素的單質生成。
請回答下列問題:
(1)寫出F元素原子結構示意圖 ,元素B在周期表中的位置 。
(2)判斷C、D、E原子半徑的大小順序 (填寫元素符號,下同),比較B和E的氣態氫化物的穩定性大小 。
(3)寫出單質D與C的最高價氧化物的水化物反應的離子方程式 。
(4)由A、B、C、E四種元素共同構成的兩種化合物在溶液中相互間可發生化學反應,試寫出該反應的離子方程式 。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(9分)下圖為周期表中的一部分。已知A、B、C、D均為短周期元素,
A與D原子序數之和為C原子序數的1.5倍。
(1)B元素符號是: _______、D在元素周期表中第_______族。
(2)四種元素中原子半徑最大的是(填元素符號)_______,B、C、D三種離子中半徑最大的是(填離子符號)_______。
(3)B比C的氫化物的沸點高是因為_____ __;A、D兩元素的氣態氫化物相互反應的生成物的電子式: ,其中存在_______鍵、_______(填“極性”或“非極性”)共價鍵。
(4)寫一個離子方程式證明C和D的非金屬性相對強弱: 。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(14分)下圖是元素周期表的一部分
| ① | | | | | | | | | | | | | | | | | |
| | ② | | | | | | | | | | | | ③ | ④ | ⑤ | | |
| ⑥ | | | | | | | | | | | | ⑦ | | | | ⑧ | |
| | | | ⑨ | | | | ⑩ | | | | | | | | | | |
| 元素代號 | I1 | I2 | I3 | I4 |
| Q | 2080 | 4000 | 6100 | 9400 |
| R | 500 | 4600 | 6900 | 9500 |
| S | 740 | 1500 | 7700 | 10500 |
| T | 580 | 1800 | 2700 | 11600 |
| U | 420 | 3100 | 4400 | 5900 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(12分)【選做題】本題包括A、B兩小題,請選定其中一小題,并在相應的答題區域內作答。若多做,則按A小題評分。
A.[物質結構與性質]
下表為元素周期表的一部分,其中的字母代表相應的元素。
| a | | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | b | c | d | | |
| | e | | | | | | | | | | | f | | g | | | |
| | | | | | | | | h | I | | | | | | | | |
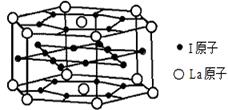
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(11分)A、B、C、D、E、F六種短周期主族元素,它們的原子序數依次增大;A有多種核素,其中一種沒有中子;B元素的最高價氧化物對應水化物與其氫化物能生成鹽;D與A同主族,且與E同周期;E元素原子的最外層電子數是其次外層電子數的3/4,A、B、D、E這四種元素,每一種與C元素都能形成原子個數比不同的多種化合物。請回答下列問題:
(1) F在元素周期表中的位置是_______________;用電子式表示A與F兩種元素組成的化合物的
形成過程______________________________________________。
已知下表中的數據是破壞1 mol物質中的化學鍵所吸收的能量(kJ),元素A的單質與元素F的單質在一定條件下反應生成2mol產物時釋放的能量為____________kJ。
| 化學鍵 | Cl2 | Br2 | I2 | HCl | HBr | HI | H2 |
| 能量(kJ) | 243 | 193 | 151 | 432 | 366 | 298 | 436 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(14分)A、B、C、D、E、F六種短周期元素,其原子序數依次增大,其中B與C同周期,D與E和F同周期,A與D同主族,C與F同主族,C元素的原子最外層電子數是次外層電子數的三倍,D是所在周期原子半徑最大的主族元素。又知六種元素所形成的常見單質在常溫常壓下有三種是氣體,三種是固體。
請回答下列問題。
(1)元素D在周期表中的位置 。
(2)C、D、F三種元素形成的簡單離子的半徑由大到小的順序是(用離子符號表示) 。
(3)若E是非金屬元素,其單質在電子工業中有重要應用,請寫出其氧化物溶于強堿溶液的離子方程式: 。
(4)若E是金屬元素,其單質與氧化鐵反應常用于焊接鋼軌,請寫出反應的化學方程式: 。冶煉金屬E時,用石墨做電極。E在(填“陰”或“陽”) 極得到,電解過程中,陽極石墨需要不斷補充,結合電極反應說明其原因是 。
(5)由A、B、C三種元素以原子個數比4:2:3形成化合物X,X中所含化學鍵類型有 。土壤中含有X中的陽離子在硝化細菌的催化作用下被氧氣氧化為其陰離子,寫出其離子方程式: 。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(15分)
A、B、D、E、F為短周期元素,非金屬元素A最外層電子數與其周期數相同,B的最外層電子數是其所在周期數的2倍。B 在D中充分燃燒能生成其最高價化合物BD2。E+與D2-具有相同的電子數。A在F中燃燒,產物溶于水得到一種強酸。回答下列問題:
(1)A在周期表中的位置是 ,寫出一種工業制備單質F的離子方程式 。
(2)B、D、E組成的一種鹽中,E的質量分數為43%,其俗名為 ,其水溶液與F單質反應的化學方程式為 ;在產物中加入少量KI,反應后加人CC14并振蕩,有 機層顯 色。
(3)由這些元素組成的物質,其組成和結構信息如下表:
| 物質 | 組成和結構信息 |
| a | 含有A的二元離子化合物 |
| b | 含有非極性共價鍵的二元離子化合物,且原子數之比為1:1 |
| c | 化學組成為BDF2 |
| d | 只存在一種類型作用力且可導電的單質晶體 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
【化學–選修3:物質結構與性質】(15分)
X、Y、Z、W四種元素原子序數依次增大且均小于36。 Z基態原子最外層電子數是其內層電子總數的3倍,Y基態原子是同周期元素中未成對電子數最多的原子,X分別與Y、Z元素組合均可形成10電子微粒, W基態原子有10個價電子。回答下列問題(以下問題均以推知元素符號作答):
(1)若 YX3與X2Z﹑YX2-與ZX-﹑Y3-與Z2-性質相似,請寫出Mg(YX2)2在一定條件下分解的化學反應方程式
⑵已知0℃時X2Z的密度為a g/cm3,其晶胞中X2Z分子的空間排列方式與金剛石晶胞類似,相似的原因是 。兩個X2Z分子間的最近距離為 pm(用a和NA表示)。 已知X2Y的升華熱是51 kJ/mol,除氫鍵外,X2Z分子間還存在范德華力(11 kJ/mol),則X2Z晶體中氫鍵的“鍵能”是 kJ/mol。
⑶ WZ是一種功能材料,已被廣泛用于電池電極、催化劑、半導體、玻璃染色劑等方面。工業上常以W(YZ3)2·6X2Z和尿素[CO(NH2)2]為原料制備。
①W2+的基態核外電子排布式為 ,其核外電子有 種運動狀態。
②尿素分子中碳原子的雜化方式為 ,1 mol尿素分子中含有的σ鍵數為 。
③YZ3-的空間構型 。
④WZ晶體的結構與NaCl相同,但天然的和絕大部分人工制備的晶體都存在各種缺陷,例如在某種WZ晶體中就存在如圖所示的缺陷:一個W2+空缺,另有兩個W2+被兩個W3+所取代。其結果晶體仍呈電中性,但化合物中W和Z的比值卻發生了變化。經測定某樣品中W3+與W2+的離子數之比為6∶91。若該晶體的化學式為WxZ,則x= 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com