

| 氫氧化物 | Fe(OH)3 | Al(OH)3 | Ca(OH)2 |
| 開始沉淀pH | 1.5 | 3.3 | 12.0 |
分析 CaO、Fe2O3、Al2O3和HCl反應溶解,而SiO2和HCl不反應,不能溶解,此時溶液中除了Ca2+外,還含有Fe3+、Al3+雜質,需除去Fe3+、Al3+但不能損失Ca2+,加NaOH,Fe3++3OH-═Fe(OH)3↓、Al3++3OH-═Al(OH)3↓,除去Fe3+、Al3+,加NaOH需將溶液的pH控制在9~10,否則氫氧化鈣沉淀,過濾得沉淀氫氧化鋁和氫氧化鐵的混合物,然后向混合體系中加入過量的氫氧化鈉,氫氧化鋁溶解得到偏鋁酸鹽,向濾液中通入過量的二氧化碳氣體得氫氧化鋁沉淀,然后灼燒得到氧化鋁;
(1)榴石礦可以看做CaO、Fe2O3、Al2O3、SiO2組成,榴石礦加鹽酸溶解后,CaO、Fe2O3、Al2O3和HCl反應溶解,而SiO2和HCl不反應,不能溶解;
(2)當NaOH過量時,溶液堿性增強,Al(OH)3會溶解,從氫氧化物沉淀的pH表中可看出,Ca(OH)2在pH為12時開始沉淀,所以堿性增強Ca(OH)2會沉淀;
(3)①濃鹽酸易揮發出氯化氫氣體溶于水得到稀鹽酸,可以和難溶于水的碳酸鈣反應生成易溶于水的氯化鈣;在實驗裝置甲和裝置乙之間增加除去CO2中含有HCl氣體的裝置,根據NaHCO3溶液能與HCl氣體反應,而不與二氧化碳反應分析;
②根據沉淀溶解平衡的書寫方法寫出,注意固體稀溶液的標注方法.
解答 解:(1)榴石礦加鹽酸溶解,CaO、Fe2O3、Al2O3和HCl反應溶解,反應方程式分別為:MgO+2HCl=MgCl2+H2O,Fe2O3+6HCl=2FeCl3+3H2O,Al2O3+6HCl=2AlCl3+3H2O.而SiO2不與鹽酸反應,以沉淀的形式除去,故答案為:Fe3+、Al3+;
(2)由(1)知,此時溶液中除了Ca2+外,還含有Fe3+、Al3+雜質,需除去Fe3+、Al3+但不能損失Ca2+,加NaOH,Fe3++3OH-═Fe(OH)3↓、Al3++3OH-═Al(OH)3↓,除去Fe3+、Al3+,加NaOH需將溶液的pH控制在9~10,若pH過高,會導致生成的Al(OH)3發生反應Al(OH)3+OH-=AlO2-+2H2O溶解,Ca(OH)2在pH為12時開始沉淀,所以堿性增強Ca(OH)2會沉淀,同時Ca2+也因轉化為沉淀而損失,
故答案為:Al(OH)3;Ca(OH)2;
(3)①實驗室通常用稀鹽酸與大理石(或石灰石)反應制取二氧化碳,反應的方程式:CaCO3+2HCl=CaCl2+H2O+CO2↑,因鹽酸易揮發出,鹽酸是強酸,通入裝置乙中的二氧化碳中含有鹽酸,溶于水得到稀鹽酸可以和難溶于水的碳酸鈣反應生成易溶于水的氯化鈣,所以沒有沉淀產生,在實驗裝置甲和裝置乙之間增加除去CO2中含有HCl氣體的裝置,NaHCO3溶液能與鹽酸反應生成氯化鈉、水和二氧化碳,在除去氯化氫的同時增加了二氧化碳的量,
故答案為:鹽酸揮發,制取的二氧化碳中含有鹽酸;在甲與乙之間加一盛有飽和碳酸氫鈉溶液的洗氣瓶;
②將二氧化碳氣體通入澄清石灰水中,石灰水變渾濁,得到碳酸鈣沉淀,碳酸鈣的溶解平衡為CaCO3(s)?Ca2+(aq)+CO32-(aq),
故答案為:CaCO3(s)?Ca2+(aq)+CO32-(aq).
點評 本題主要考查了元素化合物中金屬鋁、鐵、非金屬碳的性質,解題時不僅需熟知物質間的反應原理,還需靈活運用于實驗的設計,題目難度中等.


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:選擇題
| A. | Al13與Al14互為同素異形體 | |
| B. | Al13超原子中Al原子間是通過離子鍵結合的 | |
| C. | Al14與氫碘酸反應的化學方程式可表示為:Al14+2HI=Al14I2+H2↑ | |
| D. | Al13在一定條件下能和鎂作用生成Mg(Al13)2 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 草酸(H2C2O4)是一種重要的化工產品.草酸晶體的組成可用H2C2O4•xH2O表示,為了測定x值進行如下實驗:
草酸(H2C2O4)是一種重要的化工產品.草酸晶體的組成可用H2C2O4•xH2O表示,為了測定x值進行如下實驗:查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 濕法 | 強堿介質中,Fe(NO3)3與NaClO反應得到紫紅色高鐵酸鹽溶液 |
| 干法 | Fe2O3、KNO3、KOH混合加熱共熔生成紫紅色高鐵酸鉀(K2FeO4)和KNO2等產物 |

查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 紅熱的鐵絲在氧氣中燃燒,火星四射,生成黑色固體顆粒 | |
| B. | 鈉在空氣中燃燒,發出黃色的火焰,生成淡黃色固體 | |
| C. | 氫氣在氯氣中安靜燃燒,生成白煙 | |
| D. | 點燃的硫在氧氣中劇烈燃燒,發出藍紫色火焰 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
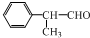 ,工業合成路線如下:
,工業合成路線如下: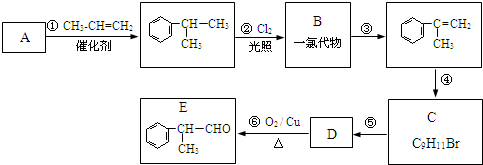
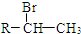
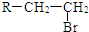 .(R-代表烴基)
.(R-代表烴基)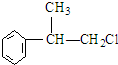 、
、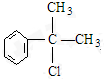 ;
;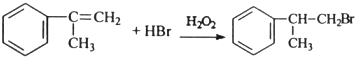 ;
;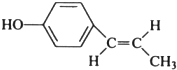 (只寫反式結構).
(只寫反式結構).查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com