
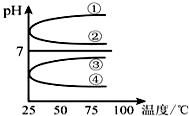
 (1)稀釋0.1mol•L-1氨水時,隨著水量的增加而減小的是①②(填寫序號).
(1)稀釋0.1mol•L-1氨水時,隨著水量的增加而減小的是①②(填寫序號).分析 (1)加水稀釋促進一水合氨電離,溶液中c(OH-)、c(NH3.H2O)、c(NH4+)都減小,溫度不變,水的離子積常數不變,則c(H+)增大;
(2)pH相同的等體積的A、B兩份溶液(A為鹽酸,B為醋酸)分別與鋅粉反應,若最后僅有一份溶液中存在鋅粉,且放出氫氣的質量相同,由于醋酸部分電離,其酸的濃度大于氫離子濃度,鹽酸中HCl的濃度等于氫離子的濃度,所以醋酸的濃度大于HCl的濃度,則鹽酸中鋅粉剩余;
(3)等體積、等物質的量濃度的氨水和鹽酸混合后恰好生成氯化銨溶液,銨根離子水解顯酸性,加熱促進水解;
(4)室溫下,向0.1mol•L-1的鹽酸與0.2mol•L-1的氨水等體積混合得到溶液為等濃度的氯化銨和一水合氨的混合溶液,一水合氨電離大于銨根離子水解,溶液顯堿性;
(5)根據鹽的水解規律:越弱越水解結合物質中水解的原理來回答;
(6)氯化鐵為強酸弱堿鹽,鐵離子水解導致溶液呈酸性;任何電解質溶液中都存在電荷守恒和物料守恒,據此分析解答.
解答 解:(1)加水稀釋促進一水合氨電離,溶液中氫氧根離子濃度、一水合氨濃度、銨根離子濃度都減小,但c(H+)增大,
①.加水稀釋促進一水合氨電離,氫氧根離子數目增大,一水合氨分子數減小,同溶液中體積不變,則$\frac{c(N{H}_{3}•{H}_{2}O)}{c(O{H}^{-})}$減小,故①正確;
②.加水稀釋促進一水合氨電離,氫氧根離子濃度減小,溫度不變,水的離子積常數不變,則氫離子濃度增大,所以$\frac{c(O{H}^{-})}{c({H}^{+})}$ 減小,故②正確;
③.溫度不變,水的離子積常數不變,所以c(H+)和c(OH-)的乘積不變,故③錯誤;
④.加水稀釋促進一水合氨電離,則OH-的物質的量增大,故④錯誤;
故答案為:①②;
(2)pH相同的等體積的A、B兩份溶液(A為鹽酸,B為醋酸)分別與鋅粉反應,若最后僅有一份溶液中存在鋅粉,且放出氫氣的質量相同,由于醋酸部分電離,其酸的濃度大于氫離子濃度,鹽酸中HCl的濃度等于氫離子的濃度,所以醋酸的濃度大于HCl的濃度,則鹽酸中鋅粉剩余;
①由于醋酸中酸過量,則反應較快,所以反應所需的時間A>B;故錯誤;
②開始pH相同,則氫離子濃度相同,所以開始時反應速率A=B,故錯誤;
③由于生成的氫氣體積相同,所以參加反應的鋅粉物質的量A=B,故正確;
④醋酸的濃度大于鹽酸的濃度,則醋酸中反應速率大,所以反應過程中的平均速率 B>A,故正確;
⑤醋酸的濃度大于鹽酸的濃度,醋酸有剩余,則鹽酸中有鋅粉剩余,故正確;
⑥醋酸的濃度大于鹽酸的濃度,醋酸有剩余,則鹽酸中有鋅粉剩余,故錯誤;
故答案為:③④⑤;
(3)等體積、等物質的量濃度的氨水和鹽酸混合后恰好生成氯化銨溶液,NH4+水解溶液顯酸性,PH<7,①②pH大于7,故①②錯誤;
加熱促進水解,加熱水解平衡向右移動,c(H+)增大,酸性增強,PH減小,③錯誤、④正確,
故答案為:④;
(4)室溫下,向0.1mol•L-1的鹽酸與0.2mol•L-1的氨水等體積混合得到溶液為等濃度的氯化銨和一水合氨的混合溶液,一水合氨電離大于銨根離子水解,溶液顯堿性,溶液中離子濃度大小為:c(NH4+)>c(Cl-)>c(OH-)>c(H+),
故答案為:c(NH4+)>c(Cl-)>c(OH-)>c(H+);
(5)由電離常數可知酸性強弱:CH3COOH>H2CO3>HCO3-,所以水解程度:碳酸根離子>碳酸氫根>醋酸根離子,所以①CH3COONa ②NaHCO3 ③Na2CO3的堿性順序是:
③>②>①,故答案為:③>②>①;
(6)氯化鐵為強酸弱堿鹽,鐵離子水解導致溶液呈酸性,水解方程式為Fe3++3H2O?Fe(OH)3+3H+;
A.H2B第一步完全電離,所以溶液中不存在H2B,應該為c(B2-)+c(HB- )=0.1mol/L,故A錯誤;
B.H2B第一步完全電離,所以溶液中不存在H2B,溶液中存在質子守恒,根據質子守恒得c(OH-)=c(H+)+c(HB-),故B錯誤;
C.根據電荷守恒得c(Na+)+c(H+ )=c(OH- )+c(HB-)+2c(B2- ),故C正確;
D.根據物料守恒得c(Na+)=2c(B2- )+2c(HB- ),故D錯誤;
故答案為:Fe3++3H2O?Fe(OH)3+3H+,C.
點評 本題考查電解質溶液之間的反應,涉及到強電解質、弱電解質的電離、鹽類的水解及溶液的pH值、離子濃度大小的比較、電離平衡常數的計算等知識,題目涉及的知識點較多,綜合性較強,題目難度中等.


 新題型全程檢測期末沖刺100分系列答案
新題型全程檢測期末沖刺100分系列答案科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 150 mL 3 mol•L-1氯酸鉀溶液 | B. | 75 mL 3 mol•L-1氯化鈣溶液 | ||
| C. | 150 mL 3 mol•L-1氯化鉀溶液 | D. | 50 mL 3 mol•L-1氯化鎂溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 將容器容積壓縮一半,平衡向右移動,達到新平衡時c(H2)<2mol•L-1 | |
| B. | 向容器中加入0.1molN2,平衡向右移動,達到新平衡時N2的體積分數小于20% | |
| C. | 若達到新平衡時c(H2)=2.5mol•L-1,則改變的條件可能是降溫或加壓 | |
| D. | 若改變條件后,H2的百分含量增大,則平衡一定向逆反應方向移動 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com