
分析 (1)鹽酸要放在最后,來除去過量的氫氧化鈉和碳酸鈉,要先加過量的氯化鋇除去硫酸根離子,然后用碳酸鈉去除過量的鋇離子
(2)根據NaClO3與鹽酸反應生成ClO2與Cl2的反應可知,生成每摩爾Cl2失去2mol電子,而生成每摩爾ClO2得到1mol電子,根據電子得失守恒計算;
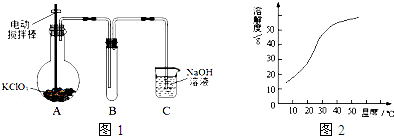
(3)工業上用稍潮濕的KClO3和草酸(H2C2O4)在60℃時反應制得ClO2、K2CO3和CO2,所以反應要用水浴加熱;
(4)從溶液中制取溶質,一般采用蒸發結晶、過濾、洗滌、干燥的方法.
解答 解:(1)要先除硫酸根離子,然后再除鈣離子,碳酸鈉可以除去過量的鋇離子,如果加反了,過量的鋇離子就沒法除去,至于加氫氧化鈉除去鎂離子順序不受限制,因為過量的氫氧化鈉加鹽酸就可以調節了,只要將三種離子除完了,過濾就行了,最后加鹽酸除去過量的氫氧根離子碳酸根離子,其次除雜操作時,往粗鹽水中先加入過量的BaCl2,至沉淀不再產生后,再加入過量的Na2CO3,和NaOH溶液,充分反應后將沉淀一并濾去;故答案為:BaCl2;Na2CO3;
(2)根據NaClO3與鹽酸反應生成ClO2與Cl2的反應可知,生成每摩爾Cl2失去2mol電子,而生成每摩爾ClO2得到1mol電子,根據電子得失守恒可知,生成ClO2與Cl2的物質的量比是2:1,故答案為:2:1;
(3)工業上用稍潮濕的KClO3和草酸(H2C2O4)在60℃時反應制得ClO2、K2CO3和CO2,所以反應要用水浴加熱,為了準確測量水浴的溫度需要用溫度計,另外水浴裝置中除酒精燈外,還需要用大燒杯,故答案為:水浴加熱;溫度計、大燒杯;
(4)從溶液中制取溶質,一般采用蒸發濃縮、冷卻(大于38℃)結晶、過濾、洗滌、干燥的方法,為防止析出晶體NaClO2•3H2O,趁熱過濾;用38℃~60℃熱水洗滌;低于60℃干燥;故答案為:蒸發濃縮; 冷卻(大于38℃)結晶.
點評 化學工藝流程題,涉及氧化還原反應電子轉移計算,化學實驗基本方法(除雜)等相關知識,題目難度中等,是高考的熱點,掌握基礎是關鍵.


科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 0.50mol•L-1 H2SO4溶液 | B. | 0.50mol•L-1 KNO3 溶液 | ||
| C. | 0.50mol•L-1酒精溶液 | D. | 0.50mol•L-1NaOH溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 水楊酸甲酯又叫冬青油,是一種重要的有機合成原料.某化學小組用水楊酸(
水楊酸甲酯又叫冬青油,是一種重要的有機合成原料.某化學小組用水楊酸( )和甲醇在酸性催化劑催化下合成水楊酸甲酯并計算其產率.
)和甲醇在酸性催化劑催化下合成水楊酸甲酯并計算其產率.| 名稱 | 分子量 | 顏色狀態 | 相對密度 | 熔點(℃) | 沸點(℃) |
| 水楊酸甲酯 | 152 | 無色液體 | 1.18 | -8.6 | 224 |
| 水楊酸 | 138 | 白色晶體 | 1.44 | 158 | 210 |
| 甲醇 | 32 | 無色液體 | 0.792 | -97 | 64.7 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
 .
.
 $\stackrel{一定條件}{→}$
$\stackrel{一定條件}{→}$
 反應的化學方程式是
反應的化學方程式是
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | CH3OH | B. | C2H5OH | C. | C3H7OH | D. | C4H9OH |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com