
【題目】實驗室制備乙炔時,氣體中常含有雜質,影響其性質的檢驗。如圖A為除雜裝置,B為性質檢驗裝置,回答下列問題:
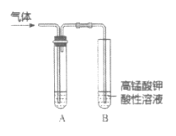
(1)實驗室中制備乙炔的化學方程式:________。
(2)A中試劑:_______。
【答案】CaC2+2H2O=Ca(OH)2+C2H2↑ CuSO4溶液
【解析】
(1)實驗室中用電石和水反應制乙炔;
(2)A中試劑主要除雜質氣體硫化氫、磷化氫等,排除它們對乙炔與酸性高錳酸鉀溶液反應的干擾。
(1) 電石和水反應制乙炔,電石的主要成分是碳化鈣,與水反應生成氫氧化鈣和乙炔,反應方程式為:CaC2+2H2O=Ca(OH)2+C2H2↑;
答案為:CaC2+2H2O=Ca(OH)2+C2H2↑;
(2)因為電石含雜質硫化鈣、磷化鈣,與水反應生成的乙炔中含有硫化氫,磷化氫等,有毒且均可使高錳酸鉀溶液褪色,會干擾乙炔與酸性高錳酸鉀溶液反應,因此用硫酸銅溶液除去硫化氫,磷化氫雜質氣體;
答案為:CuSO4溶液。


科目:高中化學 來源: 題型:
【題目】短周期主族元素 X、Y、Z、W 原子序數依次增大,X 是地殼中含量最多的元素,Y 原子的最外層只有一個電子,Z 位于元素周期表ⅢA族,W 與X屬于同一主族。下列說法正確的是
A. 原子半徑:r(W) > r(Z) > r(Y)
B. 由X、Y 組成的化合物中均不含共價鍵
C. Y 的最高價氧化物的水化物的堿性比Z的弱
D. X 的簡單氣態氫化物的熱穩定性比W的強
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖是H3AsO4水溶液中含砷的各物種分布分數(平衡時某物種的濃度占各物種濃度之和的分數)與pH的關系。下列說法錯誤的是
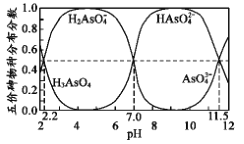
A.NaH2AsO4溶液呈酸性
B.向NaH2AsO4溶液滴加 NaOH 溶液過程中,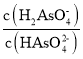 先增加后減少
先增加后減少
C.H3AsO4和HAsO42-在溶液中不能大量共存
D.Ka3( H3AsO 4) 的數量級為10-12
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】目前,國家電投集團正在建設國內首座百千瓦級鐵-鉻液流電池儲能示范電站。鐵-鉻液流電池總反應為Fe2+ + Cr3+![]() Fe3 + + Cr2+,工作示意圖如圖。下列說法錯誤的是
Fe3 + + Cr2+,工作示意圖如圖。下列說法錯誤的是

A.放電時a電極反應為 Fe 3++e- =Fe2+
B.充電時b電極反應為 Cr3++e- =Cr2+
C.放電過程中H+通過隔膜從正極區移向負極區
D.該電池無爆炸可能,安全性高,毒性和腐蝕性相對較低
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】25℃,向20.00mL 0.100 mol·L![]() HX中滴加0.100 mol·L
HX中滴加0.100 mol·L![]() NaOH過程中,pH變化如下圖所示。
NaOH過程中,pH變化如下圖所示。
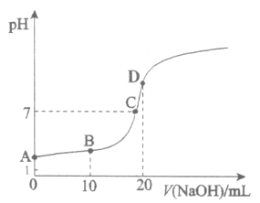
(1)寫出HX的電離方程式:__________。
(2)下列有關B點溶液的說法正確的是__________(填字母序號)。
a. 溶質為:HX、NaX
b. 微粒濃度滿足:c(Na+)+c(H+)=c(X-)+c(OH-)
c. 微粒濃度滿足:c(Na+)=c(HX)+c(X-)
d. 微粒濃度滿足:c(X-)>c(Na+)>c(H+)>c(OH-)
(3)A、C兩點水的電離程度:A__________C(填“>”、“<”或“=”)。
(4)C點對應離子濃度由大到小的順序為__________。
(5)用離子方程式解釋D點溶液pH>7的原因:_______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氮及其化合物在人們的日常生活、生產和環保事業中屬于“明星物質”。回答下列問題:
(1)氨氣是農業肥料和化工生產的重要原料,其電子式為____。
(2)疊氮化鈉(NaN3)在藥物制備、合成影像、化學分析、汽車制造等行業有著廣泛的用途,但該物質極易爆炸,且有副毒。可用NaClO溶液對含有疊氮化鈉的溶液進行處理,生成一種無污染的氣體單質,反應的化學方程式為______________。
(3)“固氮”是農業科學家研究的永恒主題。在某特殊催化劑和光照條件下,N2與水反應可生成NH3。
已知:
(i)4NH3(g)+3O2(g)![]() 2N2(g) +6H2O(g) △H1=-1266 kJ/mol;
2N2(g) +6H2O(g) △H1=-1266 kJ/mol;
(ii)H2O(g)=H2O(l) △H2= -44.0kJ/mol。
則2N2(g) +6H2O(l)![]() 4NH3(g)+3O2(g) △H3=______kJ/mol。
4NH3(g)+3O2(g) △H3=______kJ/mol。
(4)目前“人工固氮”最成功的應用就是工業合成氨:
N2(g) +3H2(g)![]() 2NH3(g) △H=-92.4kJ/mol。將1.00molN2和3.00molH2充入到容積為3L的恒容密閉容器中,發生上述反應。
2NH3(g) △H=-92.4kJ/mol。將1.00molN2和3.00molH2充入到容積為3L的恒容密閉容器中,發生上述反應。

①圖甲是測得X、Y 的濃度隨時間變化的曲線.其中Y 為_____(寫化學式),反應達到平衡時的平均反應速率v(N2) =_________。
②在不同溫度和壓強下,平衡體系中NH3的體積分數與溫度、壓強關系如圖乙,則壓強p1_____p2(填“>”“<”“=”或“不確定”,下同),B、D 兩點的平衡常數KB____KD,B 點N2 的轉化率=_________(保留3位有效數字)。
(5)“綠水青山就是金山銀山”,利用原電池原理(6NO2 +8NH3=7N2+12H2O)可以處理氮的氧化物和NH3 尾氣,裝置原理圖如圖丙:

負極反應式為__________,當有標準狀況下4.48 L NO2被處理時,轉移電子的物質的量為_____mol。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鈦白粉(TiO2)是重要的白色顏料,LiFePO4是鋰離子電池的正極材料。一種利用鈦鐵礦( 主要成分為FeTiO3 和少量Fe2O3 )進行鈦白粉和LiFePO4 的聯合生產工藝如下圖所示:

回答下列問題:
(1) LiFePO4中Fe的化合價是_______________________。
(2)鈦鐵礦“酸溶”前需要進行粉碎,粉碎的目的是__________________________________。
(3)用離子方程式表示操作I加入鐵粉的目的:__________________________。操作II為一系列操作,名稱是加熱濃縮、冷卻結晶、過濾,其中用到的陶瓷儀器的名稱是___________。
(4)TiO2+易水解,則其水解的離子方程式為______________________;“轉化”利用的是TiO2+的水解過程,需要對溶液加熱,加熱的目的是________________________________。
(5)“沉鐵”的的是使Fe3+生成FePO4,當溶液中c(PO43-)= 1.0×10-17mol/L時可認為Fe3+ 沉淀完全,則溶液中Fe3+沉淀完全時的c(Fe3+)=_______mol/L[已知:該溫度下,Ksp(FePO4)=1.0×10-22]。
(6)由“沉鐵”到制備LiFePO4的過程中,所需17% H2O2溶液與草酸( H2C2O4)的質量比是_____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】CO和H2在一定條件下合成甲醇的反應為;CO(g)+2H2(g)![]() CH3OH(g) △H1。現在容積均為1L的a、b、c、d、e五個密閉容器中分別充入1molCO和2molH2的混合氣體,控制溫度,進行實驗,測得相關數據如圖(圖1:溫度分別為300℃ 、500℃的密閉容器中,甲醇的物質的量:圖2:溫度分別為Tl~T5的密閉容器中,反應均進行到5min時甲醇的體積分數)。下列敘述正確的是
CH3OH(g) △H1。現在容積均為1L的a、b、c、d、e五個密閉容器中分別充入1molCO和2molH2的混合氣體,控制溫度,進行實驗,測得相關數據如圖(圖1:溫度分別為300℃ 、500℃的密閉容器中,甲醇的物質的量:圖2:溫度分別為Tl~T5的密閉容器中,反應均進行到5min時甲醇的體積分數)。下列敘述正確的是
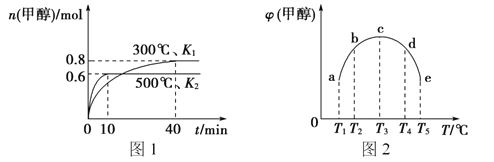
A. 該反應的△H1>0,且K1>K2
B. 將容器c中的平衡狀態轉變到容器d中的平衡狀態,可采取的措施有升溫或加壓
C. 300℃時,向平衡后的容器中再充入0.8molCO, 0.6molH2,0.2molCH3OH,平衡正向移動
D. 500℃時,向平衡后的容器中再充入1molCH3OH,重新平衡后,H2濃度和百分含量均增大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖是制備和研究乙炔性質的實驗裝置圖。下列說法不正確的是
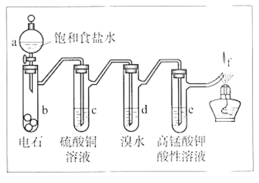
A.制備乙炔的反應原理是CaC2+2H2O→Ca(OH)2+C2H2↑
B.c的作用是除去影響后續實驗的雜質
C.e中的現象說明乙炔能被高錳酸鉀酸性溶液氧化
D.f處觀察到的現象是安靜燃燒,火焰呈淡藍色
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com