
【題目】CO和H2在一定條件下合成甲醇的反應為;CO(g)+2H2(g)![]() CH3OH(g) △H1。現在容積均為1L的a、b、c、d、e五個密閉容器中分別充入1molCO和2molH2的混合氣體,控制溫度,進行實驗,測得相關數據如圖(圖1:溫度分別為300℃ 、500℃的密閉容器中,甲醇的物質的量:圖2:溫度分別為Tl~T5的密閉容器中,反應均進行到5min時甲醇的體積分數)。下列敘述正確的是
CH3OH(g) △H1。現在容積均為1L的a、b、c、d、e五個密閉容器中分別充入1molCO和2molH2的混合氣體,控制溫度,進行實驗,測得相關數據如圖(圖1:溫度分別為300℃ 、500℃的密閉容器中,甲醇的物質的量:圖2:溫度分別為Tl~T5的密閉容器中,反應均進行到5min時甲醇的體積分數)。下列敘述正確的是
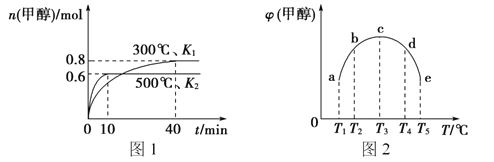
A. 該反應的△H1>0,且K1>K2
B. 將容器c中的平衡狀態轉變到容器d中的平衡狀態,可采取的措施有升溫或加壓
C. 300℃時,向平衡后的容器中再充入0.8molCO, 0.6molH2,0.2molCH3OH,平衡正向移動
D. 500℃時,向平衡后的容器中再充入1molCH3OH,重新平衡后,H2濃度和百分含量均增大
 陽光同學一線名師全優好卷系列答案
陽光同學一線名師全優好卷系列答案科目:高中化學 來源: 題型:
【題目】25℃時,濃度均為0.1 mol/L的溶液,其pH如下表所示。有關說法正確的是
序號 | ① | ② | ③ | ④ |
溶液 | NaCl | CH3COONH4 | NaF | NaHCO3 |
pH | 7.0 | 7.0 | 8.1 | 8.4 |
A.酸性強弱:H2CO3>HF
B.①和②中溶質均未水解
C.離子的總濃度:①>③
D.④中:c(HCO3-) + 2c(CO32-) + c(H2CO3)![]() 0.1 mol/L
0.1 mol/L
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】今有一混合物的水溶液,只可能含有以下離子中的若干種:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,現取三份100mL溶液進行如下實驗(已知: NH4++OH-![]() NH3↑+ H2O):
NH3↑+ H2O):
(1)第一份加入AgNO3溶液有沉淀產生;(2)第二份加足量NaOH溶液加熱后,收集到氣體0.04mol;(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27 g,經足量鹽酸洗滌、干燥后,沉淀質量為2.33 g。根據上述實驗,以下推測正確的是( )
A. K+一定存在,且100mL溶液中n(K+)≥0.02 mol
B. 100mL溶液中含0.01mol CO32-
C. Cl-一定存在
D. Ba2+一定不存在,Mg2+可能存在
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】N2O5是一種新型硝化劑,在一定溫度下可發生下列反應:2N2O5(g) ![]() 4NO2(g)+O2(g) ΔH>0,T1溫度下的部分實驗數據為:
4NO2(g)+O2(g) ΔH>0,T1溫度下的部分實驗數據為:
t/s | 0 | 500 | 1000 | 1500 |
c(N2O5)/(mol·L-1) | 5.00 | 3.52 | 2.50 | 2.50 |
下列說法不正確的是( )
A. 500 s內N2O5分解速率為2.96×10-3 mol·L-1·s-1
B. 其他條件不變,T2溫度下反應到1000s時測得N2O5(g)濃度為2.98 mol·L-1,則T1<T2
C. T1溫度下的平衡常數為K1=125,1000s時轉化率為50%
D. T1溫度下的平衡常數為K1,T3溫度下的平衡常數為K3,若K1>K3,則T1>T3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】甲~庚等元素在周期表中的相對位置如下表,己的最高價氧化物的水化物有強脫水性,甲和丁在同一周期,甲原子最外層與最內層具有相同電子數。下列判斷正確的是( )
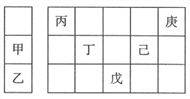
A. 丙與戊的原子序數相差25 B. 氣態氫化物的穩定性:庚<己<戊
C. 丁的最高價氧化物可用于制造光導纖維 D. 常溫下,甲和乙的單質能與水劇烈反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】根據海水綜合利用的工業流程圖,判斷下列說法不正確的是( )

A. 除去粗鹽中雜質(Mg2+、SO42-、Ca2+),加入的藥品順序為:NaOH溶液→BaCl2溶液→Na2CO3溶液→過濾后加鹽酸
B. 在過程②中將MgCl2·6H2O灼燒即可制得無水MgCl2
C. 從能量轉換角度看,氯堿工業電解飽和食鹽水是一個將電能轉化為化學能的過程
D. 從第④步到第⑤步的目的是富集Br2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】五氧化二釩(V2O5,摩爾質量為182g·mol-1)可作化學工業中的催化劑,廣泛用于冶金、化工等行業。V2O5是一種橙黃色片狀晶體,微溶于水,不溶于乙醇,具有強氧化性,屬于兩性氧化物。某研究小組將從某粗釩(主要含有V2O5,還有少量Al2O3、Fe2O3)中提取V2O5。實驗方案設計如下:

已知:NH4VO3是白色粉末,微溶于冷水,可溶于熱水,不溶于乙醇、醚。
2NH4VO3![]() V2O5+2NH3↑+H2O
V2O5+2NH3↑+H2O
請回答:
(1)第①步操作的實驗裝置如右圖所示,虛線框中最為合適的儀器是________。(填編號)
![]()
![]()
![]()
![]()

(2)調節pH為8~8.5的目的________。
(3)第④步洗滌操作時,可選用的洗滌劑_________。(填編號)
A.冷水 B.熱水 C.乙醇 D.1%NH4Cl溶液
(4)第⑤步操作時,需在流動空氣中灼燒的可能原因________。
(5)硫酸工業中,SO2轉化為SO3的催化劑就選用V2O5,催化過程經兩步完成,將其補充完整:________(用化學方程式表示),4VO2+O2=2V2O5。
(6)將0.253g產品溶于強堿溶液中,加熱煮沸,調節pH為8~8.5,向反應后的溶液中加入硫酸酸化的KI溶液(過量),溶液中含有V3+,滴加指示劑,用0.250mol·L-1Na2S2O3溶液滴定,達到終點消耗Na2S2O3標準溶液20.00mL,則該產品的純度為________。(已知:I2+2Na2S2O3=Na2S4O6+2NaI)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氯酸鎂常用作催熟劑、除草劑等,實驗室制備Mg(C1O3)2·6H2O 的流程如下:
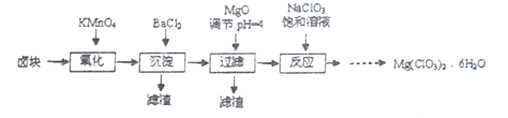
已知:①鹵塊主要成分為MgCl2·6H2O,含有MgSO4、FeCl2等雜質。
②四種化合物的溶解度(S)隨溫度(T)變化曲線如圖所示。
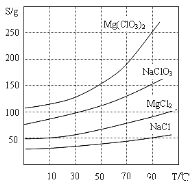
(1)過濾所需要的主要玻璃儀器有_________。
(2)加MgO后過濾所得濾渣的主要成分的化學式為_________。
(3)加入NaClO3飽和溶液后發生反應的化學方程式為__________,再進一步制取Mg(ClO3)2·6H2O的實驗步驟依次為:①________;______;洗滌;②將濾液冷卻結晶;③過濾、洗滌。
(4)產品中Mg(ClO3)2·6H2O含量的測定:(已知Mg(ClO3)2·6H2O的摩爾質量為299 g/mol)
步驟1:準確稱量3.50g產品配成100 mL溶液。
步驟2:取10.00mL于錐形瓶中,加入10.00mL稀硫酸和20.00mL1.000mol·L-1的FeSO4溶液,微熱。
步驟3:冷卻至室溫,用0.100mol/LK2Cr2O7 溶液滴定剩余的Fe2+至終點。反應的方程式為:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O。
步驟4:將步驟2、3重復兩次,平均消耗K2Cr2O7 溶液15.00mL。
① 寫出步驟2中發生反應的離子方程式__________;
② 產品中Mg(ClO3)2·6H2O的質量分數為_______。(保留到小數點后一位)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(題文)某研究小組用如圖裝置進行SO2與FeCl3溶液反應的相關實驗(夾持裝置已略去)。
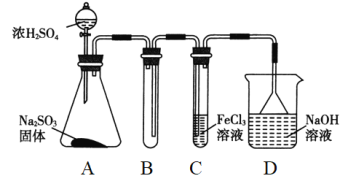
(1)通入足量SO2時C中觀察到的現象是______________________。
(2)根據以上現象,該小組同學認為SO2與FeCl3溶液發生氧化還原反應。
①寫出SO2與FeCl3溶液反應的離子方程式:_______________________;
②請設計實驗方案檢驗有Fe2+生成:_________________________;
③該小組同學向C試管反應后的溶液中加入硝酸酸化的BaCl2溶液,若出現白色沉淀,即可證明反應生成了SO42-。該做法_____(填“合理”或“不合理”),理由是______。
(3)D裝置中倒置漏斗的作用是__________________________。
(4)為了驗證SO2具有還原性,實驗中可以代替FeCl3的試劑有________(填字母)。
a.濃H2SO4 b.酸性KMnO4溶液 c.碘水 d.NaCl溶液
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com