
【題目】教材插圖具有簡潔而又內涵豐富的特點。請回答以下問題:
(1)第三周期的某主族元素,其第一至第五電離能數據如圖1所示。則該元素對應的原子有___種不同運動狀態的電子。
(2)如圖2所示.每條折線表示周期表IVA–VIIA中的某一族元素氫化物的沸點變化。請解釋AsH3比NH3沸點低的原因___。
(3)CO2在高溫高壓下所形成的晶體其晶胞如圖3所示。則該CO2晶體屬于___晶體。

(4)第一電離能介于Al、P之間的第三周期元素有__種。BCl3中B原子的雜化方式為___。
(5)Fe的一種晶體如甲、乙所示,若按甲虛線方向切乙得到的A-D圖示中正確的是__(填字母標號)。

鐵原子的配位數是___,假設鐵原子的半徑是rcm,該晶體的密度是ρg/cm3,則鐵的相對原子質量為___(設阿伏加德羅常數的值為NA)。
【答案】12 NH3存在分子間氫鍵 原子 3 sp2雜化 A 8 ![]()
【解析】
(1)根據電離能產生的突變得到最外層電子數,得到元素名稱;
(2)根據晶體類型和晶體中粒子間作用力分析;
(3)根據晶胞特點分析;
(4)同周期主族元素從左到右第一電離能呈增大趨勢,但第ⅡA族最外能層的s能級全滿,處于穩定狀態,第ⅤA族最外能層的p能級半充滿,較穩定;根據雜化軌道理論求雜化類型;
(5)相對原子質量的計算利用密度公式進行。
(1)第三周期的某主族元素,根據第一至第五電離能數據,可知,該原子第二和第三電離能變化較大,產生了突變,則該原子最外層有2個電子,為鎂元素,其核外有12個電子,每個電子的運動狀態都不同,則有12種不同運動狀態的電子;
(2) NH3分子間能形成氫鍵,而AsH3分子間無氫鍵,所以AsH3比NH3沸點低;
(3) 由CO2在高溫高壓下所形成的晶體的晶胞圖可知,在晶胞中原子之間通過共價鍵結合形成空間網狀結構的晶體,屬于原子晶體;
(4)同周期主族元素從左到右第一電離能呈增大趨勢,但第ⅡA族最外能層的s能級全滿,處于穩定狀態,第ⅤA族最外能層的p能級半充滿,較穩定,故第三周期元素的第一電離能由大到小的順序為Na<Al<Mg<Si<S<P<Cl<Ar,所以第一電離能介于Al、P之間的第三周期元素有3種;BCl3中B原子無孤電子對,成鍵電子對數為3,B的雜化方式為sp2雜化;
(5) 圖甲中Fe位于頂點和體心,乙由8個甲組成,按虛線方向切乙形成的截面邊長不等,排除B、D,由于每個小立方體的體心有一個鐵原子,故A正確;由圖甲可以看出,位于體心的鐵原子周圍距離最近的鐵原子有8個,所以鐵原子的配位數是8;
因為鐵原子的半徑是r cm,根據鐵晶胞的結構可知,晶胞的邊長為![]() ,在每個晶胞中含有鐵原子的數目為1+8×
,在每個晶胞中含有鐵原子的數目為1+8×![]() =2,設鐵原子相對原子質量為M,根據密度=質量除以體積,可得ρ=
=2,設鐵原子相對原子質量為M,根據密度=質量除以體積,可得ρ=![]() ,所以M=
,所以M=![]() 。
。


 口算題卡北京婦女兒童出版社系列答案
口算題卡北京婦女兒童出版社系列答案科目:高中化學 來源: 題型:
【題目】為探索工業廢料的再利用,某化學興趣小組設計了如圖實驗方案,用含有鋁、鐵和銅的合金制取氯化鋁、綠礬晶體(FeSO47H2O)和膽礬晶體。

請回答:
(1)步驟Ⅰ、Ⅱ、Ⅲ中均需進行的實驗操作是_______________。實驗室中進行該操作時,用到的玻璃儀器有燒杯、______________________。
(2)溶液A中的陰離子主要有__________________;由合金生成A溶液的離子方程式為:_______________。試劑X是________________。
(3)向溶液A中通入過量CO2氣體生成固體C的離子方程式為_________________。
(4)從環境保護角度考慮,采用固體F加入足量稀硫酸里加熱并鼓入空氣來制備CuSO4溶液,其化學方程式是_______________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】醫用酒精和84消毒液混合使用可能發生反應:4NaClO+CH3CH2OH![]() HCCl3+HCOONa+NaCl+2NaOH+H2O,設NA為阿伏加德羅常數,下列敘述正確的是
HCCl3+HCOONa+NaCl+2NaOH+H2O,設NA為阿伏加德羅常數,下列敘述正確的是
A.含NA個ClO-的NaClO溶液中,Na+數目為NA
B.上述反應中,每生成1molNaCl,轉移的電子數為8NA
C.100 g質量分數為46%的乙醇溶液中所含的氫原子數為6NA
D.標準狀況下,2.24 L HCCl3含有的共用電子對的數目為0.4NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某學生探究如下實驗(A):
實驗A | 條件 | 現象 |
| 加熱 | i.加熱后藍色褪去 ii.冷卻過程中,溶液恢復藍色 ⅲ.一段時間后,藍色重又褪去 |
(1)使淀粉變藍的物質是____。
(2)分析現象i、ii認為:在酸性條件下,加熱促進淀粉水解,冷卻后平衡逆向移動。
設計實驗如下,“現象a”證實該分析不合理:

“現象a”是____。
(3)再次分析:加熱后單質碘發生了變化,實驗如下:
I:取少量碘水,加熱至褪色,用淀粉溶液檢驗揮發出的物質,變藍。
Ⅱ:向褪色后的溶液中滴加淀粉溶液,冷卻過程中一直未變藍;加入稀H2SO4,瞬間變藍。
對步驟Ⅱ中稀H2SO4的作用,結合離子方程式,提出一種合理的解釋:______________。
(4)探究碘水褪色后溶液的成分:
實驗1:測得溶液的pH≈5
實驗2:取褪色后的溶液,完成如下實驗:

①產生黃色沉淀的離子方程式是____。
②Ag2O的作用是____________。
③依據上述實驗,推測濾液中含有的物質(或離子)可能是_________。
(5)結合化學反應速率解釋實驗A中現象i、現象iii藍色褪去的原因:_______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】運用化學反應原理研究碳、氮、硫的單質及其化合物的反應對緩解環境污染、能源危機具有重要意義。
I.氨為重要的化工原料,有廣泛用途。
(1)合成氨中的氫氣可由下列反應制取:
a.CH4(g)+H2O(g)![]() CO(g)+3H2(g) H1=+216.4kJ/mol
CO(g)+3H2(g) H1=+216.4kJ/mol
b.CO(g)+H2O(g)![]() CO2(g)+H2(g) H2=–41.2kJ/mol
CO2(g)+H2(g) H2=–41.2kJ/mol
則反應CH4(g)+2H2O(g)![]() CO2(g)+4H2(g)H=__。
CO2(g)+4H2(g)H=__。
(2)起始時投入氮氣和氫氣的物質的量分別為1mol、3mol,在不同溫度和壓強下合成氨。平衡時混合物中氨的體積分數與溫度的關系如圖。

①恒壓時,反應一定達到平衡狀態的標志是__(填序號)。
A.N2和H2的轉化率相等
B.反應體系密度保持不變
C.![]() 保持不變
保持不變
D.![]() =2
=2
②P1__P2(填“>”“<”“=”或“不確定”,下同);反應的平衡常數:B點__D點。
③C點H2的轉化率為__;在A、B兩點條件下,該反應從開始到平衡時生成氮氣的平均速率:v(A)___v(B)。
Ⅱ.用間接電化學法去除煙氣中NO的原理如圖所示。

(3)已知陰極室溶液呈酸性,則陰極的電極反應式為__。反應過程中通過質子交換膜(ab)的H+為2mol時,吸收柱中生成的氣體在標準狀況下的體積為__L。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】現有mA(s)+nB(g)qC(g) △H<0的可逆反應,在一定溫度下達平衡時,B的體積分數ф(B)和壓強p的關系如圖所示,則下列有關該反應的描述正確的是( )
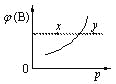
A. m+n<qB. n>q
C. x點的混合物中v (正)<v (逆)D. x點比y點的混合物的正反應速率小
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關電化學裝置的敘述正確的是

A.圖1中,Zn—MnO2干電池放電時,MnO2被氧化
B.圖2中,電解精煉銅時,陽極減少的質量與陰極增加的質量一定相等
C.圖3中,K分別與M、N連接,均可保護Fe電極,連接M時稱為“犧牲陽極的陰極保護法”
D.圖4中,在鋼材上電鍍鋁,熔融鹽中Al和Cl元素只以AlCl4-、Al2Cl7-形式存在,則陽極反應式為:Al -3e-+7AlCl4-= 4Al2Cl7-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知 25℃時,向 0.1mo/L 的碳酸氫鈉溶液滴幾滴酚酞,呈微紅色,則該溶液中
A.若滴加甲基橙溶液呈紅色
B.c(HCO3-)>c(CO32-)>c(H2CO3)
C.c(OH-)=c(H+)+ c(H2CO3)- c(CO32-)
D.若加水稀釋,![]() 的比值減小
的比值減小
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】以葡萄糖為原料制得的山梨醇(A)和異山梨醇(B)都是重要的生物質轉化平臺化合物,E 是一種治療心絞痛的藥物。由葡萄糖為原料合成 E 的路線如下:
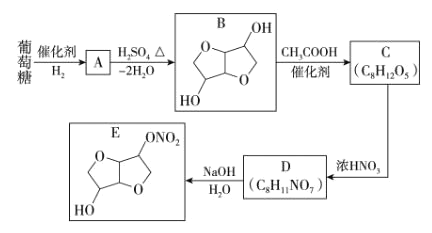
完成下列填空。
(1)A 中含有的官能團的名稱為________,由 B 到 C 的反應類型為_________。
(2)寫出 C 的結構簡式為_____________,寫出由 D 到 E 的反應方程式為 _________。
(3)設計 B 到 C 和 D 到 E 的目的是_________。
(4)F 是 B 的同分異構體,且屬于二元羧酸,分子中有 3 種化學環境不同的氫原子。寫出其結構簡式為 _________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com