
分析 有A、D、E、X、Y、Z、W七種元素,其中A、D、E、X、Y、Z是原子序數依次增大的短周期主族元素.X原子最外層電子數是其內層電子總數的3倍,原子只能有2個電子層,最外層電子數為6,故X為O元素;X、Y同族,則Y為S元素,可推知Z為Cl元素;A與X、Y既不同族也不同周期,則A為H元素;D元素某種單質的硬度最大,則D為C元素;E的原子序數介于碳、氧之間,故E為N元素;W是一種常見的金屬,其元素的含量位于地殼中金屬元素含量的第二位,則W為Fe,據此解答.
解答 解:有A、D、E、X、Y、Z、W七種元素,其中A、D、E、X、Y、Z是原子序數依次增大的短周期主族元素.X原子最外層電子數是其內層電子總數的3倍,原子只能有2個電子層,最外層電子數為6,故X為O元素;X、Y同族,則Y為S元素,可推知Z為Cl元素;A與X、Y既不同族也不同周期,則A為H元素;D元素某種單質的硬度最大,則D為C元素;E的原子序數介于碳、氧之間,故E為N元素;W是一種常見的金屬,其元素的含量位于地殼中金屬元素含量的第二位,則W為Fe.
(1)W為Fe元素,在周期表中的位置為第四周期第Ⅷ族,故答案為:第四周期第Ⅷ族;
(2)甲由H、N兩種元素組成,分子中含有18個電子,只存在共價單鍵,常溫下甲是一種無色液體,則甲為N2H4,甲在堿性溶液中能夠將CuO還原為Cu2O,當1molN2H4完全參加反應時轉移了4mol電子,設N元素在氧化產物中化合價為a,則1mol×2×[a-(-2)]=4mol,故a=0,則反應生成氮氣,還生成水,則該反應的化學方程式為:N2H4+4CuO=N2↑+2Cu2O+2H2O,故答案為:N2H4+4CuO=N2↑+2Cu2O+2H2O;
(3)處理含CO、SO2煙道氣污染的一種方法,是在催化劑作用下使兩者反應,產物之一為單質硫,C元素被氧化生成二氧化碳,反應生成1g硫固體單質時放出8.4kJ熱量,則生成1molS(s)放出的熱量為8.4kJ×$\frac{1mol×32g/mol}{1g}$=268.8kJ,此反應的熱化學方程式為:2CO(g)+SO2(g)=2CO2(g)+S(s)△H=-268.8 kJ•molˉ1 ,
故答案為:2CO(g)+SO2(g)=2CO2(g)+S(s)△H=-268.8 kJ•molˉ1 ;
(4)由鈉和O、Cl三種元素組成的一種陰、陽離子個數之比為1:1的化合物乙,其溶液顯堿性,則該化合物為NaClO,所含的化學鍵類型有:離子鍵、共價鍵,將化合物乙加入到FeCl2的溶液中,當有1mol乙參加反應時轉移2mol電子,亞鐵離子被氧化為+3價,次氯酸根離子還原為氯離子,溶液中發生的離子反應方程式為:6Fe2++3ClO-+3H2O=2Fe(OH)3↓+3Cl-+4Fe3+,故答案為:離子鍵、共價鍵;6Fe2++3ClO-+3H2O=2Fe(OH)3↓+3Cl-+4Fe3+.
點評 本題考查結構性質位置關系應用,推斷元素是解題關鍵,側重對化學用語的考查,難度中等.


科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 油滴的體積 | B. | 油滴的質量 | C. | 1 mol油酸的體積 | D. | 油酸的摩爾質量 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | HF的電離方程式及熱效應:HF(aq)═H+(aq)+F-(aq)△H>0 | |
| B. | 在氫氧化鈉溶液與鹽酸的反應中,鹽酸量一定,氫氧化鈉溶液量越多,中和熱越大 | |
| C. | △H2=-57.3 kJ•mol-1是強酸和強堿在稀溶液中反應生成可溶鹽的中和熱 | |
| D. | 稀硫酸與稀氫氧化鋇溶液反應的熱化學方程式為:H2SO4(aq)+Ba(OH)2(aq)═BaSO4(s)+2H2O(l)△H=-114.6 kJ•mol-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
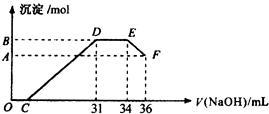 實驗研究發現,硝酸發生氧化還原反應時,硝酸的濃度越稀,對應還原產物中氮元素的化合價越低(如生成NO、N2O、N2、NH4+等).現有一定量鋁粉和鐵粉的混合物與一定量很稀的硝酸充分反應,反應過程中無氣體放出.在反應結束后的溶液中,逐滴加入4mol•L-1NaOH溶液,所加NaOH溶液的體積(mL)與產生沉淀的物質的量(mol)關系如圖所示.則
實驗研究發現,硝酸發生氧化還原反應時,硝酸的濃度越稀,對應還原產物中氮元素的化合價越低(如生成NO、N2O、N2、NH4+等).現有一定量鋁粉和鐵粉的混合物與一定量很稀的硝酸充分反應,反應過程中無氣體放出.在反應結束后的溶液中,逐滴加入4mol•L-1NaOH溶液,所加NaOH溶液的體積(mL)與產生沉淀的物質的量(mol)關系如圖所示.則查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com