
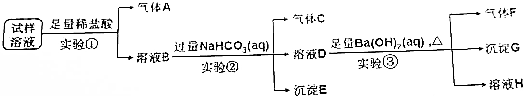
分析 (1)實驗①中加入稀鹽酸后,有無色氣體A生成,該氣體可能為二氧化碳或NO,由于鹽酸過量且溶液中陰離子種類不變,則生成的氣體為NO,溶液中一定含有Fe2+、NO3-、Cl-,且NO3-過量;根據離子共存可知一定不存在CO32-;
(2)硝酸根離子在酸性條件下具有強氧化性,能夠將亞鐵離子氧化成鐵離子,同時生成NO氣體,據此寫出反應的離子方程式;
(3)實驗①中鹽酸足量,則溶液B中含有過量的氫離子,加入碳酸氫鈉后發生反應為:H++HCO3-=H2O+CO2↑;溶液B中還含有Fe3+,當氫離子反應完全后,鐵離子與碳酸氫根離子發生雙水解反應生成氫氧化鐵沉淀和二氧化碳氣體;
當Fe3+-完全反應時,其離子濃度小于1×10-5mol•L-1,根據KsP[Fe(OH)3]=4.0×10-38=c(Fe3+)•c3(OH-)列式計算;
(4)溶液D中加入氫氧化鋇溶液加熱后生成氣體F、沉淀G和溶液H,氣體F為氨氣,由于碳酸氫鈉過量,則沉淀G中一定含有碳酸鋇,可能含有硫酸鋇;
(5)由于碳酸氫鈉過量,則生成的沉淀中不一定含有硫酸鋇,需要通過對沉淀G進一步檢驗,可向沉淀G中加入稀硝酸,若沉淀部分溶解,則說明原溶液中一定含有了酸根離子.
解答 解:(1)實驗①中加入稀鹽酸后,有無色氣體A生成,該氣體可能為CO2或NO,由于鹽酸過量且反應后溶液中陰離子種類不變,則生成的氣體為NO,溶液中一定含有Fe2+、Cl-、NO3-,且NO3-過量;根據離子共存可知一定不存在CO32-,
故答案為:Fe2+、Cl-、NO3-;CO32-;
(2)實驗①中亞鐵離子與稀硝酸反應生成硝酸鐵和一氧化氮和水,反應的離子反應方程式為:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,
故答案為:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O;
(3)實驗①加入足量鹽酸,則溶液B中含有過量的氫離子,加入碳酸氫鈉后發生反應的離子方程式為:H++HCO3-=H2O+CO2↑;溶液B中還含有Fe3+,氫離子反應完全后,鐵離子與碳酸氫根離子發生雙水解反應生成氫氧化鐵沉淀和二氧化碳氣體,反應的離子方程式為:Fe3++3HCO3-=Fe(OH)3↓+3CO2↑;當Fe3+-完全反應時,其離子濃度小于1×10-5mol•L-1,根據KsP[Fe(OH)3]=4.0×10-38=c(Fe3+)•c3(OH-)可得:c(OH-)=$\root{3}{\frac{4×1{0}^{-38}}{1×1{0}^{-5}}}$mol/L=$\root{3}{4}$×10-11mol/L,溶液中氫離子濃度:$\frac{1×1{0}^{-14}}{\root{3}{4}×1{0}^{-11}}$mol/L=$\frac{1×1{0}^{-3}}{\root{3}{4}}$,則此時溶液的pH=-lg$\frac{1×1{0}^{-3}}{\root{3}{4}}$=3+lg$\root{3}{4}$=3+$\frac{2}{3}$lg2=3.2,
故答案為:H++HCO3-=H2O+CO2↑;Fe3++3HCO3-=Fe(OH)3↓+3CO2↑;3.2;
(4)溶液D中加入足量Ba(OH)2溶液加熱后生成氣體F、沉淀G和溶液H,氣體F為NH3,由于實驗②中NaHCO3足量,則沉淀G中一定含有BaCO3,可能含有BaSO4,
故答案為:NH3;
(5)由于實驗②中NaHCO3足量,則實驗③的沉淀G中一定含有沉淀BaCO3,不能確定是否含有BaSO4,需要進行后續實驗④,可向沉淀G中加入足量的稀硝酸,若沉淀部分溶解,則證明原溶液中含有SO42-,
答:向沉淀G中加入足量的稀硝酸,若沉淀部分溶解,則證明原溶液中含有SO42-.
點評 本題考查了化學實驗基本操作方法及其綜合應用,題目難度中等,涉及離子推斷、難溶物溶度積的計算、離子方程式書寫、常見離子的檢驗等知識,明確常見化學實驗基本操作方法為解答關鍵,試題知識點較多、綜合性及其,充分考查了學生的靈活應用能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 先通過足量澄清石灰水,再通過足量品紅溶液 | |
| B. | 先通過足量飽和NaHCO3溶液,再通過澄清石灰水 | |
| C. | 先通過足量NaOH溶液,再通過澄清石灰水 | |
| D. | 先通過足量酸性KMnO4溶液,再通過澄清石灰水 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 乙烯使溴水、高錳酸鉀溶液褪色 | |
| B. | 碘片、氯化銨晶體受熱消失 | |
| C. | 二氧化硫和氯氣使品紅溶液褪色 | |
| D. | 乙醛、葡萄糖與銀氨溶液水浴加熱反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | NaHCO3的水解:HCO3-+H2O?H3O++CO32- | |
| B. | 醋酸銨的電離:CH3COONH4?CH3COO-+NH4+ | |
| C. | H2的燃燒熱為285.8kJ/mol:H2(g)+$\frac{1}{2}$O2(g)═H2O(g);△H=-285.8kJ/mol | |
| D. | 碳在高溫下還原二氧化硅 SiO2+2C$\frac{\underline{\;高溫\;}}{\;}$Si+2CO↑ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
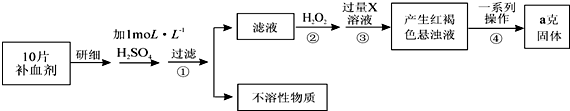
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 元素 | E1 | E2 | E3 | E4 |
| X | 522.05 | 7324.8 | 11856.6 | … |
| Y | 898.8 | 1763.58 | 14901.6 | 21084 |
| Z | 803.46 | 2436 | 3672.9 | 25116 |
| A. | X的原子電子層結構為1s22s1 | B. | Y為ⅡA族元素,其元素符號為Mg | ||
| C. | Z的價電子數為1 | D. | X的原子半徑小于Y的原子半徑 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 酸 | 電離常數K1 | 電離常數K2 |
| H2SO3 | 1.54×10-2 | 1.02×10-7 |
| H2CO3 | 4.3×10-7 | 5.6×10-11 |
| A. | pH:Na2CO3溶液小于Na2SO3溶液 | |
| B. | 結合H+能力:CO32-弱于SO32- | |
| C. | NaHSO3溶液顯酸性的原因是:NaHSO3═Na++H++SO32- | |
| D. | ①與②溶液等體積混合后的溶液中:c(SO32-)>c(CO32-)>c(HCO3-)>c(HSO3-) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 向兩種氣體中加入適量水,震蕩 | B. | 將兩種氣體分別通入AgNO3溶液中 | ||
| C. | 用濕潤的淀粉KI試紙檢驗 | D. | 將兩種氣體加壓、冷卻 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com