
【題目】電化學原理在防止金屬腐蝕、能量轉換、物質合成等方面應用廣泛。

(1)圖1中,為了減緩海水對鋼閘門A的腐蝕,材料B可以選擇__________(填字母序號)
a.碳棒 b.鋅板 c.銅板
用電化學原理解釋材料B需定期拆換的原因_______________。

(2)鎂燃料電池在可移動電子設備電源和備用電源等方面應用前景廣闊。圖2為“鎂—次氯酸鹽”燃料電池原理示意圖,電極為鎂合金和鉑合金。
①E為該燃料電池的_____________極(填“正”或“負”)。F電極上的電極反應式為_____________。
②鎂燃料電池負極容易發生自腐蝕產生氫氣,使負極利用率降低,用化學用語解釋其原因____________。
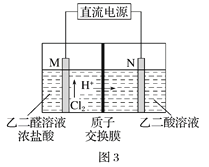
(3)乙醛酸(HOOC-CHO)是有機合成的重要中間體。工業上用“雙極室成對電解法”生產乙醛酸,原理如圖3所示,該裝置中陰、陽兩極為惰性電極,兩級室均可產生乙醛酸,其中乙二醛與M電極的產物反應生成乙醛酸。
①N電極上的電極反應式為______________。
②若有2molH+通過質子交換膜,并完全參與了反應,則該裝置中生成的乙醛酸為________________mol。
【答案】(1)b;鋅等做原電池的負極,(Zn -2e- = Zn2+),不斷遭受腐蝕,需定期拆換
(2)① 負;ClO-+2e-+H2O = Cl-+2OH-;
② Mg+2H2O= Mg(OH)2+H2↑;
(3)① HOOC-COOH+2e-+2H+ ="HOOC-CHO+" H2O;② 2。
【解析】試題分析:(1)形成原電池時,Fe作正極被保護,則要選擇活潑性比Fe強的金屬作負極,所以選鋅;鋅的活潑性比Fe強的作負極,不斷遭受腐蝕,需定期拆換;故答案為:b;鋅等做原電池的負極,(失電子,Zn-2e-═Zn2+),不斷遭受腐蝕,需定期拆換;
(2)①“鎂-次氯酸鹽”燃料電池中失電子的為負極,則Mg為負極;正極上ClO-得電子生成氯離子,則正極的電極反應式為:ClO-+2e-+H2O═Cl-+2OH-;故答案為:負;ClO-+2e-+H2O═Cl-+2OH-;
②Mg的活潑性較強能與水反應生成氫氣,其反應為:Mg+2H2O═Mg(OH)2+H2↑,故答案為:Mg+2H2O═Mg(OH)2+H2↑;
(3)①N電極上HOOC-COOH得電子生成HOOC-CHO,則電極反應式為HOOC-COOH+2e-+2H+ ═HOOC-CHO+H2O,故答案為:HOOC-COOH+2e-+2H+═HOOC-CHO+H2O;
②2mol H+通過質子交換膜,則電池中轉移2mol電子,根據電極方程式HOOC-COOH+2e-+2H+ ═HOOC-CHO+H2O,可知生成1mol乙醛酸,由于兩極均有乙醛酸生成所以生成的乙醛酸為2mol;故答案為:2。


科目:高中化學 來源: 題型:
【題目】某興趣小組探究SO2氣體還原Fe3+、I2,它們使用的藥品和裝置如圖所示:
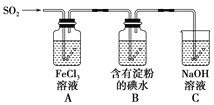
(1)A裝置中發生反應的離子方程式為_________________________________________。
(2)B裝置中發生反應的離子方程式為_________________________________________。
(3)下列實驗方案適用于在實驗室制取所需SO2的是________。
A.Na2SO3溶液與HNO3 B.Na2SO3固體與濃硫酸
C.固體硫在純氧中燃燒 D.銅與熱濃H2SO4
(4)裝置C的作用是__________________________________________________。
(5)若要從A中所得溶液提取晶體,必須進行的實驗操作步驟:蒸發、冷卻結晶、過濾、自然干燥,在這一系列操作中沒有用到的儀器有________(填序號)。
A.蒸發皿 B.石棉網 C.漏斗 D.燒杯 E.玻璃棒 F.坩堝
(6)在上述裝置中通入過量的SO2,為了驗證A中SO2與Fe3+發生了氧化還原反應,他們取A中的溶液,分成三份,并設計了如下實驗:
方案①:往第一份試液中加入酸性KMnO4溶液,紫紅色褪去。
方案②:往第二份試液中加入KSCN溶液,不變紅,再加入新制的氯水,溶液變紅。
方案③:往第三份試液中加入用稀鹽酸酸化的BaCl2,產生白色沉淀。
上述方案不合理的是________,原因是____________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】現有標準狀況下V L 氣體AB3,它的摩爾質量為M g·mol-1。則:
(1)該氣體所含原子總數為________________個(列出計算式即可,下同)。
(2)該氣體的質量為_____________g。
(3)該氣體溶于1L水中(不考慮反應),其溶液中溶質的質量分數為______________。
(4)該氣體溶于水后形成1 L溶液,其溶液的物質的量濃度為_______________ mol·L-1。
(5)該氣體溶于1L水中(不考慮反應),若所得溶液的密度為ρg·mL-1,則溶液的物質的量濃度為_____________________mol·L-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】請完成下列填空。
(1)已知氫氣的化學式是H2,其摩爾質量為______;4 g H2的物質的量為__mol,其標準狀況下的體積為_____L,其含H2分子的個數為________,含有氫原子的個數為__________;
(2)某學生欲用12 mol·L-1濃鹽酸和蒸餾水配制500 mL物質的量濃度為0.60 mol/L的稀鹽酸。該學生需要量取___________ mL上述濃鹽酸進行配制。
(3)現有21.6g由CO和CO2組成的混合氣體,在標準狀況下其體積為13.44L。回答下列問題:該混合氣體的平均摩爾質量為_____________,該混合氣體中含CO2的物質的量為__mol。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在對電子運動狀態的描述中,確定一個“軌道”應選擇以下四項中的( )
①能層②能級③電子云的伸展方向④電子的自旋狀態
A.①②③④B.①②③C.①②D.①
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)在一定條件下N2與H2反應生成NH3,請回答:
①若反應物的總能量為E1,生成物的總能量為E2,且E1>E2,則該反應為________(填“吸熱”或“放熱”)反應。
②已知拆開1 mol H—H鍵、1 mol N—H鍵、1 mol N≡N鍵分別需要的能量是436 kJ、391 kJ、946 kJ,則N2與H2反應生成NH3的熱化學方程式為________________。
(2) N2H4和H2O2混合可作火箭推進劑,已知:16 g液態N2H4和足量氧氣反應生成N2(g)和H2O(l),放出310.6 kJ的熱量;2H2O2(l)===O2(g)+2H2O(l) ΔH=-196.4 kJ·mol-1。反應N2H4(g)+O2(g)===N2(g)+2H2O(l)的ΔH=____________kJ·mol-1。N2H4和H2O2反應生成N2(g)和H2O(l)的熱化學方程式為_______________________________________。
(3)實驗室用50 mL 0.50 mol·L-1鹽酸與50 mL某濃度的NaOH溶液在如圖所示裝置中反應,通過測定反應過程中所放出的熱量可計算中和熱。該裝置有兩處明顯的錯誤,其中一處是缺少一種玻璃儀器,該儀器的名稱為____________;實驗室提供了0.50 mol·L-1和0.55 mol·L-1兩種濃度的NaOH溶液,應選擇_____________mol·L-1的NaOH溶液進行實驗。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】X、Y、Z、L、M五種元素的原子序數依次增大。X、Y、Z、L是組成蛋白質的基礎元素,M是地殼中含量最高的金屬元素。
回答下列問題:
(1) 元素M的核外電子排布式________ ;元素L的電子排布圖為________ ;
(2)五種元素的原子半徑從大到小的順序是____________(用元素符號表示)。Y、Z、L的電離能由大到小的順序是______________(用元素符號表示)
(3)Z、X兩元素按原子數目比l∶3和2∶4構成分子A和B,A的分子空間構型為__________,中心原子的雜化方式是________,A的電子式為____________,B的結構式為____________。
(4)NO3-的空間構型為__________;寫出NO3-互為等電子體的一種分子的化學式_____________。
(5)鉛、鋇、氧形成的某化合物的晶胞結構是:Pb4+處于立方晶胞頂點,Ba2+處于晶胞中心,O2-處于晶胞棱邊中心,該化合物化學式為____,每個Ba2+與__個O2-配位。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某硝酸鹽受熱分解生成金屬氧化物、二氧化氮和氧氣,生成的二氧化氮和氧氣的物質的量之比為8:1,則金屬元素的化合價在反應過程中的變化是
A. 升高 B. 降低 C. 不變 D. 無法確定
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知木炭在一定條件下與濃硝酸反應生成兩種+4價的氧化物,為了探究一氧化氮(NO)能否與過氧化鈉反應,以及反應后的產物中是否有亞硝酸鈉(NaNO2),某小組同學設計了如圖所示裝置(夾持儀器和連接用的膠管已經省略)。

(1)為了完成該實驗,虛線框內還需要連接B~E四套裝置,按氣流方向連接的順序為:
a→( )( )→( )( )→( )( )→ ( )( )(填儀器接口的字母編號)。連接好儀器,檢查氣密性,裝入藥品后,要通入一段時間的氮氣,再滴加濃硝酸,點燃酒精燈,通入氮氣的主要目的是 。
(2)裝置E中觀察到的主要實驗現象有 。
(3)裝置C的作用是 。
(4)某同學經查閱資料后發現亞硝酸是弱酸,性質不穩定,室溫下易分解生成一氧化氮。裝置D中充分反應后,設計實驗證明D中是否有亞硝酸鈉生成: 。(寫出檢驗步驟及現象)。
(5)亞硝酸鈉在酸性條件下可將I-氧化為I2,同時生成NO,該反應常用于亞硝酸鈉含量的測定,請寫出該反應的離子方程式: 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com