
| 元素代號 | A | B | D | E | G | H | I | J |
| 化合價 | -1 | -2 | +4、-4 | +4、-2 | +5、-3 | +3 | +2 | +1 |
| 原子半徑/nm | 0.071 | 0.074 | 0.077 | 0.102 | 0.110 | 0.143 | 0.160 | 0.186 |
 .
.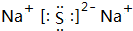 .
. 分析 短周期元素中,B、E均有-2價,處于ⅥA族,且原子半徑E>D,則D為O、E為S;A有-1價,原子半徑小于O,且與O原子半徑相差不大,則A為F元素;D有+4、-4價,處于IV族,原子半徑大于氧,且與氧原子半徑相近,故D為碳元素;G有+5、-3價,原子半徑大于S,故G為P;J、I、H化合價分別為+1、+2、+3,分別處于ⅠA族、ⅡA族、ⅢA族,原子半徑J>I>H,且大于P原子半徑,故J為Na、I為Mg、H為Al,據此解答.
解答 解:短周期元素中,B、E均有-2價,處于ⅥA族,且原子半徑E>D,則D為O、E為S;A有-1價,原子半徑小于O,且與O原子半徑相差不大,則A為F元素;D有+4、-4價,處于IV族,原子半徑大于氧,且與氧原子半徑相近,故D為碳元素;G有+5、-3價,原子半徑大于S,故G為P;J、I、H化合價分別為+1、+2、+3,分別處于ⅠA族、ⅡA族、ⅢA族,原子半徑J>I>H,且大于P原子半徑,故J為Na、I為Mg、H為Al.
(1)E為S元素,處于第三周期VIA族,故答案為:三;VIA;
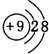
(2)電子層結構相同的離子,核電荷數越大離子半徑越小,離子電子層越多離子半徑越大,故離子半徑:F->Na+>Al3+,F-離子結構示意圖為 ,
,
故答案為:F->Na+>Al3+; ;
;
(3)上述元素的最高價氧化物對應水化物的酸性最強的為硫酸,堿性最強的為NaOH,這兩種元素形成化合物為Na2S,電子式為 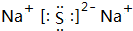 ,
,
故答案為:S;Na;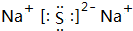 .
.
點評 本題考查結構性質位置關系應用,關鍵是根據化合價與原子半徑推斷元素,注意對元素周期律的理解掌握.


科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
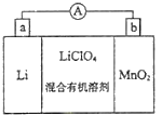 如圖是鋰錳電池的反應原理示意圖,其中電解質KClO4溶于混合有機溶劑中,Li+ 通過電解質遷移入MnO2晶格中,得到LiMnO2.回答下列問題:
如圖是鋰錳電池的反應原理示意圖,其中電解質KClO4溶于混合有機溶劑中,Li+ 通過電解質遷移入MnO2晶格中,得到LiMnO2.回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 亞硫酸鈉 | B. | 硝酸銀 | C. | 碳酸鈉 | D. | 氯化鋁 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
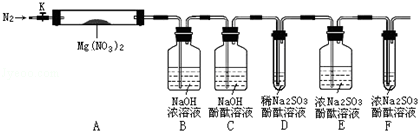
 ,步驟Ⅱ中,通入一段時間N2的目的是避免對分解產物O2的檢驗產生干擾.
,步驟Ⅱ中,通入一段時間N2的目的是避免對分解產物O2的檢驗產生干擾.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com