

| 實驗組 | 溫度/℃ | 起始量/mol | 平衡量/mol | 達平衡所需時間/min | ||
| CO | H2O | CO | H2 | |||
| 1 | 650 | 2 | 4 | 0.5 | 1.5 | 5 |
| 2 | 900 | 1 | 2 | 0.5 | 0.5 | - |
分析 (1)根據方程式3SiO2(s)+6C(s)+2N2(g)?Si3N4(s)+6CO(g)△H=-1591.2kJ/mol,可知每轉移12mol電子,放出1591.2kJ熱量,據此計算;
(2)①根據題目信息寫出生成物,根據質量守恒配平;
②由圖可知鎂-次氯酸鹽”燃料電池中Mg與ClO-、H2O反應生成Cl-與Mg(OH)2,正極上是次氯酸根離子得到電子生成氯離子;
(3)①根據v=$\frac{△c}{△t}$計算v(H2),再根據速率之比等于化學計量數之比計算v(CO2);
②a.容器內CO、H2O、CO2、H2的濃度不再變化,則說明反應處于平衡狀態;
b.恒溫、恒容條件下,氣體的總物質的量始終不變,壓強始終不變;
c.恒容條件下,反應物和產物都是氣體,密度始終不變;
d.υ正(CO)=υ逆(CO2),轉化成CO2的正、逆反應速率相等;
e.該反應氣體的物質的量不變,氣體的質量也不變,所以反應過程中氣體的平均相對分子質量不變;
③c到達平衡,而b點未達到平衡,正反應速率減小,逆反應速率增大至相等;該反應達到平衡后,因反應為放熱反應且反應容器為絕熱容器,故容器內溫度升高,反應逆向進行;
解答 解:(1)根據方程式3SiO2(s)+6C(s)+2N2(g)?Si3N4(s)+6CO(g)△H=-1591.2kJ/mol,可知每轉移12mol電子,放出1591.2kJ熱量,所以每轉移1mole-,可放出的熱量為132.6kJ,
故答案為:132.6kJ;
(2)①用CO還原MgSO4可得到MgO、CO2、SO2和SO3,方程式為CO+2MgSO4 $\frac{\underline{\;高溫\;}}{\;}$2MgO+CO2+SO2+SO3;
故答案為:CO+2MgSO4 $\frac{\underline{\;高溫\;}}{\;}$2MgO+CO2+SO2+SO3;
②由圖可知鎂-次氯酸鹽”燃料電池中Mg與ClO-、H2O反應生成Cl-與Mg(OH)2,該電池反應的總反應方程式為Mg+ClO-+H2O=Cl-+Mg(OH)2,正極電極反應是ClO-離子得到電子發生還原反應,電極反應為:ClO-+2e-+H2O=Cl-+2OH-,負極電極反應是Mg失去電子發生氧化反應,電極反應為:Mg-2e-+2OH-=Mg(OH)2,
故答案為:ClO-+2e-+H2O=Cl-+2OH-;
(3)①v(H2)=$\frac{\frac{1.5mol}{2L}}{5min}$=0.15mol/(L.min),速率之比等于化學計量數之比,則v(CO2)=v(H2)=0.15mol/(L.min),
故答案為:0.15mol/(L.min);
②②a.容器內CO、H2O、CO2、H2的濃度不再變化,則說明反應處于平衡狀態,故a正確;
b.恒溫、恒容條件下,氣體的總物質的量始終不變,壓強始終不變,故b錯誤;
c.恒容條件下,反應物和產物都是氣體,密度始終不變,故c錯誤;
d.υ正(CO)=υ逆(CO2),轉化成CO2的正、逆反應速率相等,說明反應處于平衡狀態,故d正確;
e.該反應氣體的物質的量不變,氣體的質量也不變,所以反應過程中氣體的平均相對分子質量不變,所以不能說明反應是否處于平衡狀態,故e錯誤,
故選:ad;
③c到達平衡,而b點未達到平衡,正反應速率減小,逆反應速率增大至相等,故b點υ正>υ逆;
該反應達到平衡后,因反應為放熱反應且反應容器為絕熱容器,故容器內溫度升高,反應逆向進行,故t3~t4時刻,H2O(g)的轉化率降低,
故答案為:>;該反應達到平衡后,因反應為放熱反應且反應容器為絕熱容器,故容器內溫度升高,反應逆向進行.
點評 本題考查的知識點較多,既考查了電化學又考查了反應熱的問題,對學生綜合運用知識能力有一定的要求,特別是根據圖中信息寫電極反應,要求學生有較好從圖中獲取信息的能力,整個題目難度較大.本題考查化學平衡計算、平衡狀態判斷、化學平衡影響因素、原電池等,注意理解掌握化學平衡常數的應用.


 探究與鞏固河南科學技術出版社系列答案
探究與鞏固河南科學技術出版社系列答案科目:高中化學 來源: 題型:選擇題
| A. | 陽極反應為Fe-2e-═Fe2+ | |
| B. | 電解過程中溶液pH不會變化 | |
| C. | 過程中有Fe(OH)3沉淀生成 | |
| D. | 電路中每轉移12 mol電子,最多有1 mol Cr2O72-被還原 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
| t/min | 2 | 4 | 7 | 9 |
| n(H2O)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 如圖裝置中,容器甲內充入0.1mol NO氣體,干燥管內裝有一定量Na2O2,從A處緩慢通入CO2氣體.恒溫下,容器甲中活塞緩慢由D向左移動,當移至C處時容器體積縮小至最小,為原體積的$\frac{9}{10}$,干燥管中物質的質量增加2.24g隨著CO2的繼續通入,活塞又逐漸向右移動.已知:2Na2O2+2CO2═2Na2CO3+O2 2NO+O2═2NO2 2NO2?N2O4(不考慮活塞的摩擦)下列說法中正確的是( )
如圖裝置中,容器甲內充入0.1mol NO氣體,干燥管內裝有一定量Na2O2,從A處緩慢通入CO2氣體.恒溫下,容器甲中活塞緩慢由D向左移動,當移至C處時容器體積縮小至最小,為原體積的$\frac{9}{10}$,干燥管中物質的質量增加2.24g隨著CO2的繼續通入,活塞又逐漸向右移動.已知:2Na2O2+2CO2═2Na2CO3+O2 2NO+O2═2NO2 2NO2?N2O4(不考慮活塞的摩擦)下列說法中正確的是( )| A. | 活塞從D處移動到C處的過程中,通入CO2體積為2.24L(標準狀況) | |
| B. | NO2轉化為N2O4的轉換率為20% | |
| C. | 活塞移至C處后,繼續通入0.01mol CO2,此時活塞恰好回到D處 | |
| D. | 若改變干燥管中Na2O2的量,要通過調節甲容器的溫度及通入CO2的量,使活塞發生從D到C,又從C到D的移動,則Na2O2的質量應大于1.56g |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 銀電極是負極 | B. | X電極是鋅電極 | ||
| C. | 去掉鹽橋電流計指針仍偏轉 | D. | Y溶液為AgNO3溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

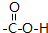 .
.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com