
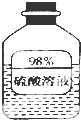
 (1)如圖信息,瓶中溶液長期放置后溶質質量分數變小,是因為該物質具有吸水性.
(1)如圖信息,瓶中溶液長期放置后溶質質量分數變小,是因為該物質具有吸水性.分析 (1)根據濃硫酸具有吸水性來回答判斷;
(2)①H2SO4+BaCl2=BaSO4↓+2HCl,根據沉淀的質量結合化學方程式計算即可;
②廢水含有H2SO4、HNO3,硝酸和氯化鋇之間不會發生反應,但是硝酸、硫酸和氫氧化鉀均反應,據此回答.
解答 解:(1)濃硫酸具有吸水性,瓶中溶液長期放置后,溶質質量不變,但是溶劑質量增加,所以溶質質量分數變小,故答案為:吸水;
(2)①解:設廢水中含硫酸的質量為x,
H2SO4+BaCl2=BaSO4↓+2HCl
98 233
x 11.65g
$\frac{98}{x}=\frac{233}{11.65g}$,解得x=4.9g,所以廢水中H2SO4的溶質質量分數為$\frac{4.9g}{50g}$×100%=9.8%,答:50g廢水中H2SO4的溶質質量分數是9.8%;
②工業廢水含有H2SO4、HNO3,硝酸和氯化鋇之間不會發生反應,但是改用氫氧化鉀,硝酸、硫酸和氫氧化鉀均反應,所以測定50g廢水消耗的氫氧化鉀的量比硫酸消耗的高,即硫酸的含量偏高,故答案為:偏高;廢水中含有硝酸,硝酸也會消耗氫氧化鉀.
點評 本題涉及濃硫酸的性質以及有關化學方程式的計算知識,注意相關知識的應用梳理是重點,難度不大.


 靈星計算小達人系列答案
靈星計算小達人系列答案 孟建平錯題本系列答案
孟建平錯題本系列答案科目:高中化學 來源: 題型:解答題
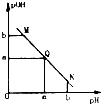 某溫度下,向一定體積0.1mol/L醋酸溶液中逐滴加入等濃度的NaOH溶液,溶液中pOH(pOH=-1g[OH+])與pH的變化關系如圖所示,則
某溫度下,向一定體積0.1mol/L醋酸溶液中逐滴加入等濃度的NaOH溶液,溶液中pOH(pOH=-1g[OH+])與pH的變化關系如圖所示,則查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
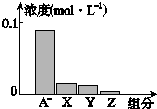 常溫下,0.2mol•L-1的一元酸HA與等濃度NaOH溶液等體積混合后,所得溶液中部分微粒組分及濃度所示,下列說法正確的是( )
常溫下,0.2mol•L-1的一元酸HA與等濃度NaOH溶液等體積混合后,所得溶液中部分微粒組分及濃度所示,下列說法正確的是( )| A. | HA為強酸 | B. | 該混合溶液pH=7.0 | ||
| C. | 該混合溶液中:c(A-)+c(Y)=c(Na+) | D. | 圖中X表示HA,Y表示OH-,Z表示H+ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 采用步行、騎自行車等外出是較為低碳的出行方式 | |
| B. | 防止“白色污染”,將廢棄塑料集中到野外焚燒 | |
| C. | 熟石灰可以改良酸性土壤,又能和硫酸銨混合使用 | |
| D. | 微量元素是人體必需的,應盡可能多吃含微量元素的營養補劑 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 2014年3.15晚會的主題為“讓消費更有尊嚴”,食品行業依舊是消費者最為關注的行業.頻發的食品安全事件,讓公眾幾乎患上了“食物焦慮癥”.國際環保組織綠色和平發布報告,稱對“立頓”的綠茶、茉莉花茶和鐵觀音袋泡茶檢驗,發現含有被國家禁止在茶葉上使用的高毒農藥滅多威.滅多威是一種白色晶狀固體,略具有硫磺的氣味,其化學式為C5H10N2O2S.
2014年3.15晚會的主題為“讓消費更有尊嚴”,食品行業依舊是消費者最為關注的行業.頻發的食品安全事件,讓公眾幾乎患上了“食物焦慮癥”.國際環保組織綠色和平發布報告,稱對“立頓”的綠茶、茉莉花茶和鐵觀音袋泡茶檢驗,發現含有被國家禁止在茶葉上使用的高毒農藥滅多威.滅多威是一種白色晶狀固體,略具有硫磺的氣味,其化學式為C5H10N2O2S.查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 13C與15N有相同的中子數 | B. | 13C與C60互為同位素 | ||
| C. | 15N與14N互為同位素 | D. | 15N的核外電子數與中子數相同 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com