
 有A、B、C、D、E、F六種短周期元素,其元素特征信息如下:
有A、B、C、D、E、F六種短周期元素,其元素特征信息如下:分析 短周期元素中,A的單質是密度最小的物質,則A為H元素;B的單質能與冷水劇烈反應,所得強堿性溶液中含有兩種電子數相同的陰、陽離子,則B為Na;C的原子最外層電子數是其內層電子數的三倍,原子只能有2個電子層,最外層電子數為6,故C為O元素;D與B(Na)同周期,該周期中D的簡單離子半徑最小,則D為Al;B、C、E組成的36電子的化合物Y是家用消毒劑的主要成分,則E為Cl,Y為NaClO;F元素最高正價與最低負價的代數和為4,則F為S元素,據此解答.
解答 解:短周期元素中,A的單質是密度最小的物質,則A為H元素;B的單質能與冷水劇烈反應,所得強堿性溶液中含有兩種電子數相同的陰、陽離子,則B為Na;C的原子最外層電子數是其內層電子數的三倍,原子只能有2個電子層,最外層電子數為6,故C為O元素;D與B(Na)同周期,該周期中D的簡單離子半徑最小,則D為Al;B、C、E組成的36電子的化合物Y是家用消毒劑的主要成分,則E為Cl,Y為NaClO;F元素最高正價與最低負價的代數和為4,則F為S元素.
(1)兩種均含H、Na、O、S四種元素的化合物為NaHSO4、NaHSO3,在溶液中相互反應的離子方程式為:H++HSO3-=SO2↑+H2O,
故答案為:H++HSO3-=SO2↑+H2O;
(2)電子層結構相同的離子,核電荷數越大離子半徑越小,離子電子層越多,離子半徑越大,故離子半徑:S2->Cl->Al3+,
故答案為:S2->Cl->Al3+;
(3)向Fe和Al單質組成的混合物中,加入足量稀硫酸,固體全部溶解.向所得的溶液中加入過量的氫氧化鈉溶液,將產生的沉淀過濾出來,經洗滌、干燥、灼燒后得到一種固體為氧化鐵,經稱量發現氧化鐵的質量和原混合物的質量恰好相等,所以鋁的質量相當于氧元素的質量,則原混合物中Al單質的質量分數等于氧化鐵中O元素的質量分數=$\frac{16×3}{56×2+16×3}$×100%=30%,
故答案為:30%;
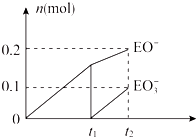
(4)根據圖象知,次氯酸根離子的物質的量為0.2mol,氯酸根離子的物質的量為0.1mol,所以次氯酸根離子的物質的量與氯酸根離子的物質的量之比為2:1,根據得失電子守恒知,氯氣和氫氧化鈣的反應方程式為:10Cl2+10Ca(OH)2=7CaCl2+2Ca(ClO)2+Ca(ClO3)2+10H2O;
故答案為:10Cl2+10Ca(OH)2=7CaCl2+2Ca(ClO)2+Ca(ClO3)2+10H2O;
(5)H、Na形成的化合物NaHBA在有機合成中用途很廣泛,它可以奪取很多化合物中的質子而生成相應的鈉的化合物,它與乙醇反應的化學方程式為:NaH+CH3CH2OH→CH3CH2ONa+H2↑,
故答案為:NaH+CH3CH2OH→CH3CH2ONa+H2↑.
點評 本題考查結構性質位置關系應用,正確推斷元素是解題關鍵,(3)中關鍵是理解氧化鐵中的氧元素質量相當于鋁元素的質量,側重考查學生對知識的遷移運用能力考查,難度中等.


科目:高中化學 來源: 題型:選擇題
| A. | Q2=$\frac{{Q}_{1}}{2}$ | B. | Q2>$\frac{{Q}_{1}}{2}$ | C. | Q2<Q1<Q | D. | Q=Q1>Q2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
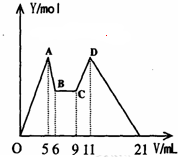 在氯化鋁和氯化鎂的混合溶液中,向其中滴加a mLC1mol•L-1 NaOH之后,改成滴加C2mol•L-1HCl,所得沉淀Y(mol)與試劑總體積V(mL)間的關系如右圖所示.則所加入NaOH溶液的體積為( )
在氯化鋁和氯化鎂的混合溶液中,向其中滴加a mLC1mol•L-1 NaOH之后,改成滴加C2mol•L-1HCl,所得沉淀Y(mol)與試劑總體積V(mL)間的關系如右圖所示.則所加入NaOH溶液的體積為( )| A. | 9mL | B. | 7.5mL | C. | 7ml | D. | 6mL |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Fe2O3$\stackrel{HCl(aq)}{→}$FeCl3(aq)$\stackrel{△}{→}$無水FeCl3 | |
| B. | Al2O3$→_{△}^{NaOH(aq)}$NaAlO2(aq)$\stackrel{HCl(aq)}{→}$AlCl3 | |
| C. | NH3$\stackrel{O_{2}}{→}$NO$\stackrel{O_{2},H_{2}O}{→}$HNO3 | |
| D. | 飽和NaCl(aq)$\stackrel{NH_{3},CO_{2}}{→}$NaHCO3$\stackrel{△}{→}$Na2CO3 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 實驗步驟 | 實驗方法 | 觀察到的現象 |
| 步驟1 | ||
| 步驟2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | NH4Cl與濃H2SO4混合共熱,生成的氣體用堿石灰進行干燥 | |
| B. | N2+3H2$?_{高溫、高壓}^{催化劑}$2NH3,用燒堿進行干燥 | |
| C. | 加熱濃氨水,氣體用堿石灰干燥 | |
| D. | 加熱NH4HCO3,氣體用P2O5干燥 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 實驗序號 | 實驗操作 | 現象 | 結論 |
| ① | 加品紅溶液 | 溶液褪色 | 氯氣與水反應的產物有漂白性 |
| ② | 加入NaHCO2粉末 | 有無色氣泡產生 | 氯氣與水反應的產物具有較強的酸性 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 反應 | 大氣固氮 N2(g)+O2(g)?2NO(g) | 工業固氮 N2(g)+3H2(g)?2NH3(g) | |||
| 溫度/℃ | 27 | 2000 | 25 | 400 | 450 |
| K | 3.84×10-31 | 0.1 | 5×108 | 0.507 | 0.152 |
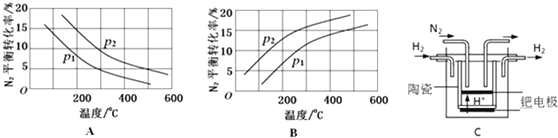
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| 選項 | 實驗目的 | 操作或現象 |
| A | 檢驗甲酸溶液中是否含有甲醛 | 向溶液中加入氫氧化鈉溶液,中和甲酸后,加入新制的氫氧化銅加熱,有紅色沉淀產生 |
| B | 證明蛋白質在某些無機鹽溶液作用下發生變性 | 向雞蛋清溶液中加入硫酸銅溶液,有沉淀析出;再把沉淀加入蒸餾水中 |
| C | 檢驗蔗糖是否已水解 | 向蔗糖溶液中加入4滴稀硫酸,煮沸幾分鐘,冷卻,再加入銀氨溶液,水浴加熱 |
| D | 檢驗溴乙烷中的溴元素 | 將少量溴乙烷與NaOH溶液混合共熱,充分反應并冷卻后,向上層清液中加稀HNO3酸化,再滴加AgNO3溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com