
分析 (1)反應后溶質為等濃度的醋酸鈉和醋酸,混合液的pH=6,溶液顯酸性,氫離子濃度為c(H+)=1×10-6mol/L,則氫氧根離子濃度為:c(OH-)=1×10-8mol/L,結合電荷守恒進行計算;
(2)根據(jù)c(待測)=$\frac{V(標準)×c(標準)}{V(待測)}$分析不當操作對V(標準)×的影響,以此判斷濃度的誤差;
(3)若所得混合液的pH=2,根據(jù)c(H+)=$\frac{c(酸)V(酸)-c(堿)V(堿)}{V(酸)+V(堿)}$計算酸堿的體積比.
解答 解:(1)反應后溶質為等濃度的醋酸鈉和醋酸,混合液的pH=6,溶液顯酸性,則c(H+)>c(OH-),由電荷守恒c(CH3COO-)+c(OH-)=c(Na+)+c(H+)可知,c(CH3COO-)>c(Na+),則溶液中粒子濃度關系為:c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-);已知氫離子濃度為c(H+)=1×10-6mol/L,則氫氧根離子濃度為:c(OH-)=1×10-8mol/L,根據(jù)電荷守恒可知:c(CH3COO-)-c(Na+)=c(OH-)-c(H+)=1×10-6mol/L-1×10-8mol/L=9.9×10-7mol/L;
故答案為:c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-);9.9×10-7mol/L;
(2)A.配制標準溶液的固體NaOH中混有KOH雜質,則在滴定時消耗的鹽酸偏少,所以鹽酸的體積一定時,消耗的標準溶液的體積偏大,則測定結果偏大,故A正確;
B.滴定終點讀數(shù)時,仰視滴定管的刻度,則標準溶液的體積偏大,則測定結果偏大,故B正確,
C.盛裝未知液的錐形瓶用蒸餾水洗過后再用未知液潤洗,錐形瓶中鹽酸的物質的量偏大,滴定時消耗的標準溶液的體積偏大,所以測定結果偏大,故C正確;
D.滴定到終點讀數(shù)時,發(fā)現(xiàn)滴定管尖嘴處懸掛一滴溶液,則消耗的標準溶液的體積偏大,所以測定結果偏大,故D正確;
故答案為:ABCD;
(3)某溫度下水的離子積為KW=1×10-13,若所得混合液的pH=2,則有$\frac{0.1b-0.01a}{a+b}$=0.01,解得a:b=9:2,
故答案為:9:2.
點評 本題考查酸堿混合的定性判斷、pH的有關計算、酸堿中和滴定誤差分析等,會根據(jù)溶液的酸堿性及電荷守恒判斷離子濃度大小,注意(1、3)中水的離子積常數(shù)是10-13而不是10-14,否則會導致錯誤,為易錯點;側重于考查學生對基礎知識的應用能力和計算能力.


科目:高中化學 來源: 題型:解答題
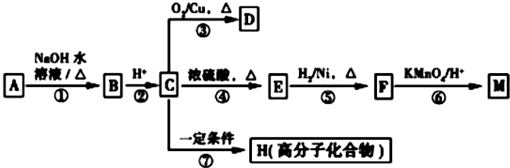
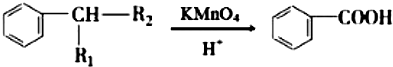 (R1、R2表示烴基或氫原子)
(R1、R2表示烴基或氫原子)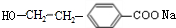 .
.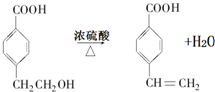 .
.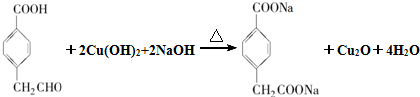 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
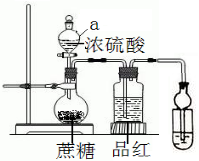 在燒瓶放20克蔗糖,依次加入少量水、20mL濃硫酸,蔗糖逐漸變黑,體積膨脹,形成疏松多孔的黑面包,燒瓶發(fā)燙,品紅溶液顏色變淡.請回答:
在燒瓶放20克蔗糖,依次加入少量水、20mL濃硫酸,蔗糖逐漸變黑,體積膨脹,形成疏松多孔的黑面包,燒瓶發(fā)燙,品紅溶液顏色變淡.請回答:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:推斷題

 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 用消毒液殺滅游泳池中的藻類 | |
| B. | 用CaCl2融化路面的積雪 | |
| C. | 用石灰修復被酸雨浸蝕的土壤 | |
| D. | 用催化劑將汽車尾氣中的CO和NO轉化為無害物質 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 常溫下0.4 mol/L HB溶液和 0.2 mol/L NaOH溶液等體積混合后溶液的pH=3,則混合溶液中離子濃度的大小順序為:c(B-)>c(H+)>c(Na+)>c(OH-) | |
| B. | 等濃度的下列稀溶液:①硫酸氫鈉 ②乙酸鈉 ③醋酸 ④碳酸氫鈉 ⑤硝酸鈉 ⑥苯酚鈉,它們的pH由小到大排列為:③⑤①④②⑥ | |
| C. | 常溫下0.1 mol/L的下列溶液 ①NH4Al(SO4)2 ②NH4Cl ③NH3•H2O ④CH3COONH4中c (NH4+)由大到小的順序是:②>①>④>③ | |
| D. | 在25℃時,將a mol•L-1的氨水與0.01 mol•L-1的鹽酸等體積混合反應時溶液中c(NH4+)=c(Cl-).用含a的代數(shù)式表示NH3•H2O的電離常數(shù)Kb=$\frac{1{0}^{-9}}{a-0.01}$ |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com