
 燃煤能排放大量的CO、CO2、SO2,PM2.5(可入肺顆粒物)污染也跟冬季燃煤密切相關.SO2、CO、CO2也是對環境影響較大的氣體,對它們的合理控制、利用是優化我們生存環境的有效途徑.
燃煤能排放大量的CO、CO2、SO2,PM2.5(可入肺顆粒物)污染也跟冬季燃煤密切相關.SO2、CO、CO2也是對環境影響較大的氣體,對它們的合理控制、利用是優化我們生存環境的有效途徑.| 實驗組 | 溫度℃ | 起始量/mol | 平衡量/mol | 達到平衡所需 時間/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
分析 (1)SO2在負極失去電子轉化為SO42-,根據電極反應式的書寫方法來回答;
(2)應用蓋斯定律解題,始終抓住目標反應和已知反應之間的關系應用數學知識來解;
(3)①第二組溫度比第一組高,反應物物質的量比第一組減半,但是平衡時CO2的物質的量比第一組的一半少,表明該反應為放熱反應;利用三段式計算平衡時,各組分的物質的量,該反應是氣體體積不變的反應,故利用物質的量代替濃度代入平衡常數表達式計算平衡常數;
②在反應中當反應物的物質的量之比等于化學計量數之比時,各反應物的轉化率相等,某一種反應物越多,其轉化率越低,而另一種反應物的轉化率則越高,據此答題;
③根據濃度商Qc與平衡常數K的大小,判斷反應進行的方向,進而確定正逆反應的速率;
④當化學反應達到平衡狀態時,正逆反應速率相等,各物質的濃度不再發生變化,根據密度和平均相對分子質量的公式進行分析解答該題.
解答 解:(1)SO2在負極失去電子轉化為SO42-,故其電極反應為:SO2+2H2O-2e-=SO42-+4H+,
故答案為:SO2+2H2O-2e-=SO42-+4H+;
(2)應用蓋斯定律解題,△H=-△H1-△H2+$\frac{3}{2}$△H3+2△H4=-($\frac{3}{2}$c+2d-a-b)kJ•mol-1,所以CH3OH(l)燃燒熱的熱化學方程式為CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-($\frac{3}{2}$c+2d-a-b)kJ•mol-1,
故答案為:CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-($\frac{3}{2}$c+2d-a-b)kJ•mol-1;
(3)①實驗1中CO的轉化率為×100%=40%,實驗2中CO的轉化率為×100%=20%,則實驗1的轉化率大于實驗2,則說明溫度升高平衡向逆反應方向移動,正反應放熱,
平衡時CO的物質的量為1.6mol,則:
CO(g)+H2O(g)?CO2(g)+H2(g),
開始(mol):2 1 0 0
變化(mol):0.4 0.4 0.4 0.4
平衡(mol):1.6 0.6 0.4 0.4
該反應前后氣體體積不變,故利用物質的量代替濃度計算平衡常數,故900℃時該反應平衡常數k=$\frac{0.4×0.4}{1.6×0.6}$=0.17,
故答案為:<;0.17;
②在反應中當反應物的物質的量之比等于化學計量數之比時,各反應物的轉化率相等,某一種反應物越多,其轉化率越低,而另一種反應物的轉化率則越高,所以要使CO的轉化率大于水蒸氣,則0<$\frac{a}{b}$<1,故答案為:0<$\frac{a}{b}$<1;
③900℃時,在此容器中加入CO、H2O、CO2、H2均為1mol時,濃度商Qc=1>0.17=K,所以此時平衡要逆向移動,故V正<V逆,故答案為:<;
④A.CO2減少的化學反應速率和CO減少的化學反應速率相等,證明正逆反應速率相等,達到了平衡,故正確;
B.反應前后氣體系數和相等,容器內氣體壓強始終保持不變,所以壓強不變的狀態不一定平衡,故錯誤;
C.CO、H2O、CO2、H2的濃度都不再發生變化,是化學平衡狀態的特征,故正確;
D.容器中氣體的平均相對分子質量等于質量和物質的量的比值,質量和物質的量都不變化,所以容器中氣體的平均相對分子質量始終不隨時間而變化,此時的狀態不一定是平衡狀態,故錯誤.
故選AC.
點評 本題考查熱反應方程式、化學平衡計算、化學平衡影響因素、化學平衡常數計算等,側重考查學生對圖象與數據的分析及計算能力,注意對知識的理解與掌握,難度中等.


科目:高中化學 來源: 題型:解答題
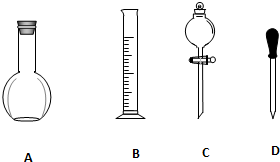 實驗室需要0.1mol/L NaOH溶液900mL和0.5mol/L的硫酸溶液500mL.根據這兩種溶液的配制情況回答下列問題.
實驗室需要0.1mol/L NaOH溶液900mL和0.5mol/L的硫酸溶液500mL.根據這兩種溶液的配制情況回答下列問題.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 銅及其化合物在科學研究和工業生產中具有許多用途.
銅及其化合物在科學研究和工業生產中具有許多用途. ;
;查看答案和解析>>
科目:高中化學 來源: 題型:解答題
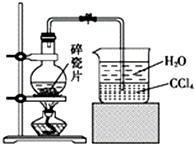 1-溴異戊烷[(CH3)2CHCH2CH2Br]是有機合成的重要中間體,可用于生產染料、催化劑等,其沸點為121℃,易溶于CCl4,可由異戊醇與氫溴酸在硫酸催化作用下反應而得:(CH3)2CHCH2CH2OH+HBr$\stackrel{△}{→}$(CH3)2CHCH2CH2Br+H2O.已知異戊醇的沸點為132.5℃,微溶于水,易溶于CCl4.實驗室制備1-溴異戊烷的裝置如圖所示.
1-溴異戊烷[(CH3)2CHCH2CH2Br]是有機合成的重要中間體,可用于生產染料、催化劑等,其沸點為121℃,易溶于CCl4,可由異戊醇與氫溴酸在硫酸催化作用下反應而得:(CH3)2CHCH2CH2OH+HBr$\stackrel{△}{→}$(CH3)2CHCH2CH2Br+H2O.已知異戊醇的沸點為132.5℃,微溶于水,易溶于CCl4.實驗室制備1-溴異戊烷的裝置如圖所示.| 反應物 | NaBr | 98.3% 濃H2SO4 | 異戊醇 | 水 |
| 用量 | 0.30mol | 35mL(過量) | 0.25mol | 30mL |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 化合物 | 相對分子質量 | 密度/g•cm-3 | 沸點,/℃ | 溶解度/l00g水 |
| 正丁醇 | 74 | 0.80 | 118.0 | 9 |
| 冰醋酸 | 60 | 1.045 | 118.1 | 互溶 |
| 乙酸正丁酯 | 116 | 0.882 | 126.1 | 0.7 |
 CH3COOCH2CH2CH2CH3+H2O.
CH3COOCH2CH2CH2CH3+H2O.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Zn和濃H2SO4 | B. | C和濃HNO3 | ||
| C. | Cu和濃HNO3 | D. | Na2O2和NH4Cl濃溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 向NaClO溶液中通入過量SO2:ClO-+SO2+H2O═HClO+HSO3- | |
| B. | Na2S投入水中:S2-+2H2O?H2S+2OH- | |
| C. | 向含1molAlCl3溶液中投入4molNa:Al3++4Na+2H2O═AlO2-+4Na++2H2↑ | |
| D. | 向明礬溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:2Al3++3SO42-+3Ba2++6OH-═Al(OH)3↓+3BaSO4↓ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 某溶液中由水電離出的c(H+)=1×10-amol•L-1,若a>7時,則該溶液的pH一定為14-a | |
| B. | 將0.2mol•L-1的某一元酸HA溶液和0.1mol•L-1的NaOH溶液等體積混合后溶液的pH大于7,則反應后的混合液:c(HA)>c(A-) | |
| C. | Na2CO3溶液:c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) | |
| D. | 常溫下NaHSO3溶液的pH<7,溶液中c(SO32-)<c(H2SO3) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 稀醋酸與氫氧化鈉溶液反應:H++OH-═H2O | |
| B. | 銅粉與稀硝酸反應:Cu+2H+═Cu2++H2↑ | |
| C. | 氯氣與碘化鉀溶液反應:Cl2+2I-═I2+2Cl- | |
| D. | 碳酸鈣與足量鹽酸反應:CO32-+2H+═H2O+CO2↑ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com