
 檢測血液中的Ca2+能夠幫助判斷多種疾病.某研究小組測定血液樣品中Ca2+的含量(l00mL血液中含Ca2+的質量),實驗步驟如下:
檢測血液中的Ca2+能夠幫助判斷多種疾病.某研究小組測定血液樣品中Ca2+的含量(l00mL血液中含Ca2+的質量),實驗步驟如下:分析 (1)A.H2C2O4溶液中存在電荷守恒,草酸分步電離;
B.相同溫度下,等物質的量濃度的(NH4)2C2O4和(NH4)2Fe(SO4)2溶液,草酸根離子水解促進銨根離子水解,亞鐵離子水解抑制銨根離子水解;
C.(NH4)2C2O4溶液中存在物料守恒;
D.(NH4)2Fe(SO4)2溶液中銨根離子水解減小,亞鐵離子濃度小于銨根離子濃度,溶液中銨根離子和亞鐵離子水解顯酸性:
(2)實驗中發現向草酸溶液中逐滴加入酸性高錳酸鉀溶液,溶液褪色開始時緩慢,一段時間后迅速加快,利用水浴使反應液保持恒溫時也是如此,說明反應生成的錳離子對反應有催化作用;
(3)高錳酸鉀溶液具有強氧化性,能腐蝕橡膠管;
(4)到達滴定終點時的現象是滴入最后一滴,溶液紫紅色褪去且半分鐘不恢復證明反應達到反應終點;
(5)若步驟⑤滴定管在使用前未用標準(NH4)2Fe(SO4)2溶液洗滌,消耗標準(NH4)2Fe(SO4)2溶液體積增大,則與草酸反應的高錳酸鉀溶液體積減小,測定鈣離子濃度偏低;
(6)2MnO4-+5H2C2O4+6H+═10CO2+2Mn2++8H2O,MnO4-+5Fe2++8H+=5Fe3++Mn2++4H2O,結合反應定量關系,計算過量的KMnO4的物質的量,從而得到與H2C2O4反應的KMnO4的物質的量,5Ca2+~5CaC2O4~5H2C2O4~2MnO4-,MnO4-~5Fe2+~5(NH4)2Fe(SO4)2,據此計算鈣離子含量.
解答 解:(1)A.H2C2O4分步電離,溶液中存在電荷守恒,c(H+)=c(HC2O4-)+2c(C2O42-)+c(OH-),故A錯誤;
B.相同溫度下,等物質的量濃度的(NH4)2C2O4和(NH4)2Fe(SO4)2溶液,草酸根離子水解促進銨根離子水解,亞鐵離子水解抑制銨根離子水解,c(NH4+)前者小于后者,故B正確;
C.(NH4)2C2O4溶液中存在物料守恒,c(NH4+)+c(NH3•H2O)=2c(HC2O4-)+2c(C2O42-)+2c(H2C2O4),故C正確;
D.(NH4)2Fe(SO4)2溶液中銨根離子水解減小,亞鐵離子濃度小于銨根離子濃度,:c(SO42-)>c(NH4+)>c(Fe2+)>c(H+)>c(OH-),故D錯誤;
故答案為:B C;
(2)實驗中發現向草酸溶液中逐滴加入酸性高錳酸鉀溶液,溶液褪色開始時緩慢,一段時間后迅速加快,利用水浴使反應液保持恒溫時也是如此,說明反應生成的錳離子對反應有催化作用,反應生成的Mn2+催化了反應的進行,使褪色速率變快,
故答案為:反應生成的Mn2+催化了反應的進行,使褪色速率變快;
(3)高錳酸鉀溶液具有強氧化性,能腐蝕橡膠管,12.00mL0.0010mol•L-1的KMnO4溶液應用酸式滴定管,
故答案為:酸式滴定管;
(4)到達滴定終點時的現象是滴入最后一滴高錳酸鉀溶液,錐形瓶中溶液顏色從淺紫色變成無色且半分鐘內不變色,說明反應達到終點,
故答案為:最后一滴溶液滴下,錐形瓶中溶液顏色從淺紫色變成無色且半分鐘內不變色;
(5)若步驟⑤滴定管在使用前未用標準(NH4)2Fe(SO4)2溶液洗滌,消耗標準(NH4)2Fe(SO4)2溶液體積增大,過量的KMnO4溶液體積增大,與草酸反應的高錳酸鉀物質的量減小,則和草酸鈣反應的測得血液中Ca2+的含量將偏低,
故答案為:偏低;
(6)KMnO4的總物質的量為:0.0010 mol•L-1×12×10-3L=1.2×10-5 mol,
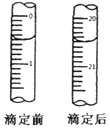
2MnO4-+5H2C2O4+6H+═10CO2+2Mn2++8H2O,MnO4-+5Fe2++8H+=5Fe3++Mn2++4H2O,結合反應定量關系得到:滴定終點消耗(NH4)2Fe(SO4)2溶液體積讀取得到20.00ml,
MnO4-~5Fe2+~5(NH4)2Fe(SO4)2,
1 5
n 0.02000L×0.0020mol•L-1
n=8×10-6mol,
與H2C2O4反應的KMnO4的量為:1.2×10-5 mol-8.0×10-6 mol=4.0×10-6 mol,
5Ca2+~5CaC2O4~5H2C2O4~2MnO4-,
5 2
n 4×10-6mol
n(Ca2+)=1×10-5mol
準確量取5.00mL血液樣品,處理后配制成50.00mL溶液中含鈣離子物質的量=1×10-5mol×$\frac{50}{10}$=5×10-5mol,
l00mL血液中含Ca2+的質量=$\frac{100}{5}$×5×10-5mol×40g/mol=0.040g,
故答案為:0.040.
點評 本題考查了弱電解質電離、電解質溶液中守恒關系的分析判斷、離子反應方程式的書寫以及計算、滴定實驗過程的理解應用,綜合性較強,正確書寫離子反應方程式是計算的關鍵,題目難度中等.


科目:高中化學 來源: 題型:實驗題

| 實驗步驟 | 預期的現象和結論 |
| ①測定B中實驗所用混合溶液的 ②配制具有相同pH的稀硝酸與 BaCl2的混合液并通入適當的N2 ③將SO2通入上述溶液中 | 若出現白色沉淀則假設2成立 若不出現白色沉淀則假設2不成立 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 鋅和稀硫酸 | B. | 碳酸鈣和硫酸 | ||
| C. | 過氧化氫和二氧化錳 | D. | 硫酸銨和氫氧化鈉 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 化學家可以在微觀層面上操縱分子和原子,組裝分子材料 | |
| B. | 化學是一門具有創造性的科學,化學的特征就是認識分子和制造分子 | |
| C. | 化學是在原子、分子的水平上研究物質的一門自然科學 | |
| D. | 化學注重理論分析、推理,而不需要做化學實驗 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 強電解質都易溶于水,所以BaSO4是弱電解質 | |
| B. | 氨氣的水溶液可以導電,但氨氣屬于非電解質 | |
| C. | 使用催化劑可以讓不自發的化學反應自發進行 | |
| D. | 電解質溶液的導電過程屬于物理變化 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①③⑥⑦ | B. | ①②④③⑥ | C. | ①⑥⑦ | D. | ①⑥ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 2.24升 | B. | 3.36升 | C. | 4.48升 | D. | 5.6升 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源:2017屆山東省高三上第一次教學診斷化學卷(解析版) 題型:選擇題
已知電離平衡常數:H2CO3>HClO>HCO3-,氧化性:HClO>Cl2>Br2>Fe3+>I2。下列有關離子反應或離子方程式的敘述中,正確的是
A.向FeI2溶液中滴加少量氯水,反應的離子方程式為:2Fe2++Cl2=2Fe3++2Cl-
B.向溴水中加入足量氯化亞鐵溶液能使溴水變成無色
C.向NaClO溶液中通入少量CO2的離子方程式:2ClO-+CO2+H2O=2HClO+CO32-
D.能使pH試紙顯深紅色的溶液,Fe3+、Cl-、Ba2+、Br-能大量共存
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com