
【題目】“化學是一門中心學科,與社會、生活、科研密切的關系。”下列敘述中,不正確的是
A.大量使用燃煤發電是形成霧霾的主要原因
B.天然氣、煤氣大量泄漏遇到明火會爆炸
C.利用化學反應可實現12C到14C的轉化
D.晶體硅可用于光伏發電、制造芯片
科目:高中化學 來源: 題型:
【題目】A、B、C、D、E五種短周期元素,它們的原子序數依次增大;A元素是所有原子中半徑最小的原子;B元素的最高價氧化物對應水化物與其氫化物生成一種鹽X;D與A同主族,且與E同周期;E元素的最外層電子數是其次外層電子數的3/4,A、B、D、E這四種元素中,每一種都與C元素形成原子個數比不相同的化合物.
請回答下列問題:
(1)C和E兩元素相比較,非金屬性較強的是(填元素名稱),可以驗證該結論的是(填寫編號);
A.比較這兩種元素的氣態氫化物的沸點
B.比較這兩種元素的單質在常溫下的狀態
C.比較這兩種元素的氣態氫化物的穩定性
D.比較這兩種元素的單質與氫氣化合的難易
(2)寫出C、D兩元素形成的原子個數比為1:1的化合物與E、C兩元素形成的原子個數比為1:2的化合物反應的化學方程式: .
(3)A、C、D、E四種元素可形成兩種酸式鹽,兩種酸式鹽相互反應的離子方程式為
(4)A和E,A和C可形成甲、乙兩種微粒,它們均為負一價雙原子陰離子,且甲有18個電子,乙有10個電子,則甲與乙反應的離子方程式為;
(5)B元素的氣態氫化物和其一種常見氧化物(雙原子分子)能反應生成B的單質,該反應中氧化產物與還原產物的物質的量之比為 .
(6)在火箭推進器中裝有液態B2A4和液態A2C2 , 已知0.4mol.液態B2A4和足量液態A2C2反應,生成氣態B2和氣態A2C,放出256.6kJ的熱量.試寫出該反應的熱化學方程式: . B2A4的電子式
(7)A2C的沸點比A2E 沸點 , 原因是
(8)下列事實可以用氫鍵解釋的是
A.水比硫化氫穩定.
B.氨氣易液化.
C.氨氣極易溶于水.
D.水結成冰,密度減小,體積增大.
(9)用電子式表示氯化氫的形成過程 .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(I)SO2氣體為無色氣體,有強烈刺激性氣味,大氣主要污染物之一,具有一定的還原性,探究SO2氣體還原Fe3+、I2,可以使用的藥品和裝置如下圖所示:
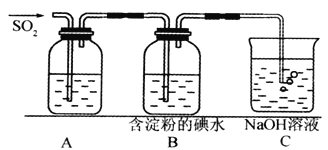
(1)若要從FeCl3溶液中提取晶體,在必須進行的實驗操作步驟中,沒有用到的玻璃儀器有________________(填字母)。
a.酒精燈 b.燒瓶 c.漏斗 d.燒杯 e.玻璃棒
(2)裝置A中的現象是__________________,寫出B中發生反應的離子方程式:__________________。
(3)在上述裝置中通入過量的SO2,為了驗證A中SO2與Fe3+發生了氧化還原反應,取A中的溶液,分成兩份,并設計了如下試驗
方案①:向第一份溶液中加入少量酸性KMnO4溶液,紫紅色褪去。
方案②:向第二份溶液中加入KSCN溶液,不變紅,再加入新制的氯水,溶液變紅。
上述方案中不合理的是_______________(填序號)。
(Ⅱ)SO2溶于水生成亞硫酸,亞硫酸的酸性強于次氯酸。選擇下面的裝置和藥品來探究亞硫酸與次氯酸的酸性強弱。
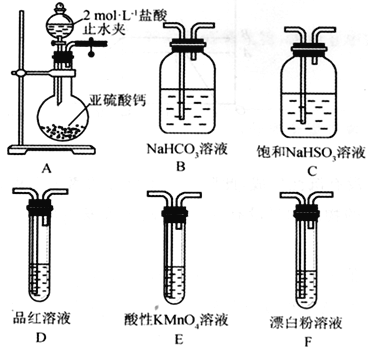
(4)裝置正確的連接順序為A、________________________________、D、F,其中裝置B的作用是_________。證明亞硫酸的酸性強于次氯酸的現象為_____________________________。
(Ⅲ)某同學對SO2與漂粉精的反應進行了實驗探究。
操作 | 現象 |
取4 g漂粉精固體,加入100 mL水 | 部分固體溶解,溶液略有顏色 |
過濾,測漂粉精溶液的pH | pH試紙先變藍(約為12),后褪色 |
| ①溶液出現渾濁,并變為黃綠色 ②稍后,產生大量白色沉淀,黃綠色褪去 |
(5)C12和Ca(OH)2反應制取漂粉精的化學方程式是______________________________________。
(6)pH試紙顏色的變化說明漂粉精溶液具有的性質是__________________________________。
(7)現象①中溶液變為黃綠色的可能原因:隨溶液酸性的增強,漂粉精的有效成分ClO-和Cl-發生反應。寫出漂粉精在酸性條件下發生反應的離子方程式:_________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列敘述與圖像對應符合的是( )

A. 對于達到平衡狀態的N2(g)+3H2(g)![]() 2NH3(g)在t0時刻充入了一定的NH3,平衡逆向移動
2NH3(g)在t0時刻充入了一定的NH3,平衡逆向移動
B. 對于反應2X(g)+3Y(g)![]() 2Z(g) ΔH<0,y可以表示Z的百分含量
2Z(g) ΔH<0,y可以表示Z的百分含量
C. 該圖像表示的方程式為2A=B+3C
D. p2>p1,T1>T2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法中正確的是
①元素電負性越大表示該元素的金屬性越強 ②元素電負性越大表示該元素的非金屬性越強 ③元素電負性很小表示該元素的單質不發生化學反應 ④元素電負性很大表示該元素的單質在發生化學反應時一般易得到電子
A.①③B.①④C.②③D.②④
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在化學反應中,只有極少數能量比平均能量高得多的反應物分子發生碰撞時才可能發生化學反應,這些分子被稱為活化分子.使普通分子變成活化分子所需提供的最低限度的能量叫活化能,其單位通常用kJmol﹣1表示.請認真觀察如圖,然后回答問題. 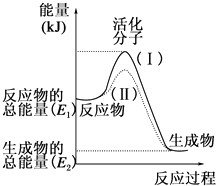
(1)圖中所示反應是(填“吸熱”或“放熱”)反應.
(2)已知拆開1mol H﹣H鍵、1mol I﹣I、1mol H﹣I鍵分別需要吸收的能量為436kJ、151kJ、299kJ.則由1mol氫氣和1mol 碘反應生成HI會(填“放出”或“吸收”)kJ的熱量.在化學反應過程中,是將轉化為 .
(3)下列反應中,屬于放熱反應的是 , 屬于吸熱反應的是 .
①物質燃燒
②炸藥爆炸
③酸堿中和反應
④二氧化碳通過熾熱的碳
⑤食物因氧化而腐敗
⑥Ba(OH)28H2O與NH4Cl反應
⑦鐵粉與稀鹽酸反應.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列電離方程式正確的是( )
A. 醋酸溶于水:CH3COOH===CH3COO-+H+
B. NaHSO4溶于水:NaHSO4===Na++HSO4-
C. 碳酸氫鈉溶于水:NaHCO3![]() HCO
HCO![]() +Na+
+Na+
D. 次氯酸溶于水:HClO![]() H++ClO-
H++ClO-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】LiAlH4( )、LiH既是金屬儲氫材料又是有機合成中的常用試劑,遇水均能劇烈分解釋放出H2,LiAlH4在125℃分解為LiH、H2和Al。下列說法不正確的是( )
)、LiH既是金屬儲氫材料又是有機合成中的常用試劑,遇水均能劇烈分解釋放出H2,LiAlH4在125℃分解為LiH、H2和Al。下列說法不正確的是( )
A. 1 mol LiAlH4在125℃完全分解,轉移3 mol電子
B. LiH與D2O反應,所得氫氣的摩爾質量為4 g/mol
C. LiAlH4溶于水得到無色溶液,化學方程式可表示為:LiAlH4 + 2H2O![]() LiAlO2 + 4H2↑
LiAlO2 + 4H2↑
D. LiAlH4與乙醛作用生成乙醇,LiAlH4作還原劑
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于有機化合物的說法正確的是( )
A. 乙烯和聚乙烯都能使溴的四氯化碳溶液褪色
B. 乙烷和乙烯都能使酸性KMnO4溶液褪色
C. 植物油和動物脂肪都不能使溴水褪色
D. 乙醇和乙酸都能與金屬鈉反應
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com