
| A. | 當光束通過下列分散系:有塵埃的空氣、豆漿、墨水都能觀察到丁達爾效應 | |
| B. | 溶液、膠體、濁液的根本區別是分散質微粒直徑的大小 | |
| C. | 把1mL0.1mol/L三氯化鐵溶液滴加入20mL沸水中,邊加邊振蕩,可制得氫氧化鐵膠體 | |
| D. | 膠體的穩定性介于溶液和濁液之間,屬于介穩體系 |
分析 A.分散系分為溶液、膠體、濁液.丁達爾效應是指:當一束光線透過膠體,從入射光的垂直方向可以觀察到膠體里出現的一條光亮的“通路.丁達爾現象是膠體特有的性質;
B.分散質微粒直徑的大小是溶液、膠體、濁液的根本區別;
C.將氯化鐵飽和溶液逐滴加入沸水中,制得氫氧化鐵膠體溶液;
D.膠體粒子直徑在1-100nm之間,溶液的粒子直徑小于1nm,濁液的子直徑大于100nm.
解答 解:A.有塵埃的空氣,屬于膠體分散系,具有丁達爾現象,豆漿是膠體,有丁達爾效應,墨水是膠體,具有丁達爾效應,故A正確;
B.溶液、膠體、濁液的根本區別是分散質微粒直徑的大小,分散質微粒直徑為1-100nm的分散系為膠體,小于1nm的分散系為溶液,大于100nm的分散系為濁液,故B正確;
C.將氯化鐵飽和溶液逐滴加入沸水中,繼續加熱至呈紅褐色,制得氫氧化鐵膠體溶液,不能振蕩,故C錯誤;
D.膠體粒子直徑在1-100nm之間,溶液的粒子直徑小于1nm,濁液的子直徑大于100nm,分散質直徑越大,越不穩定,所以膠體是介于溶液和濁液之間的在一定條件下能穩定存在的介穩體系,故C正確.
故選C.
點評 本題考查了膠體性質分析判斷、膠體概念的理解,掌握基礎是解題關鍵,題目較簡單.


科目:高中化學 來源: 題型:解答題
| 時間t(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
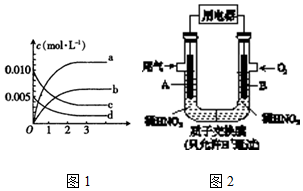
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
| 活性炭/mol | NO/mol | A/mol | B/mol | ρ/Mpa | |
| 200℃ | 2.000 | 0.0400 | 0.0300 | 0.0300 | 3.93 |
| 335℃ | 2.005 | 0.0500 | 0.0250 | 0.0250 | ρ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
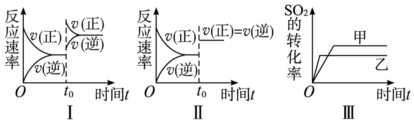
| A. | 圖Ⅰ研究的是t0時刻增大O2的濃度對反應速率的影響 | |
| B. | 圖Ⅲ研究的是溫度對化學平衡的影響,且乙的溫度較低 | |
| C. | 圖Ⅲ研究的是催化劑對平衡的影響,且甲的催化效率比乙高 | |
| D. | 圖Ⅱ研究的是t0時刻加入催化劑后對反應速率的影響 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 需要加熱才能發生的反應一定是吸熱反應 | |
| B. | △H>0表示產物的總能量低于反應物的總能量 | |
| C. | △H 的單位kJ•mol-1,熱量Q的單位為kJ | |
| D. | 化學鍵斷裂過程中釋放能量 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | $\frac{1}{44}$ mol-1 | B. | $\frac{x}{22}$ mol-1 | C. | $\frac{3x}{44}$ mol-1 | D. | $\frac{44x}{3}$ mol-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com