
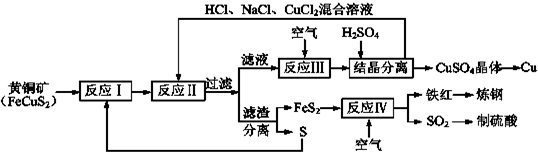
分析 流程中反應Ⅰ的化學化方程為CuFeS2+S═FeS2+CuS,黃銅礦與S在高溫下煅燒,使其轉變為FeS2、CuS,加入HCl、NaCl、CuCl2混合溶液 發生反應Cu2++CuS+4Cl-=2[CuCl2]-+S↓,過濾得到濾液中通入空氣發生反應4CuCl2-+O2+4H+=4Cu2++8Cl-+2H2O,一定溫度下,在反應Ⅲ所得的溶液中加入稀硫酸,可以析出硫酸銅晶體,結晶分離得到硫酸銅晶體,加入鐵還原溶液得到銅;濾渣分離得到FeS和S,
(1)由流程可知,黃鐵礦分解生成的Fe、Cu均為+2價;
(2)反應Ⅲ中生成銅離子;
(3)考慮產物的溶解度,溶解度小的先從溶液中析出;
(4)煉鋼時為了降低含碳量,可將鐵紅投入熔融的生鐵中,氧化鐵和碳反應生成鐵和一氧化碳;
(5)二氧化硫中硫元素化合價+4價,處于硫元素的中間價態,表現氧化性可以利用二氧化硫和硫化氫反應生成淡黃色沉淀硫單質,NaHSO3、NH4HSO3,其水溶液均呈酸性,亞硫酸氫鈉溶液中亞硫酸氫根離子電離程度大于其水解程度,亞硫酸氫銨溶液中銨根離子水解程度大于亞硫酸氫根水解程度溶液顯酸性;
(6)SO2通入Fe(SO4)3溶液中,發生氧化還原反應生成硫酸亞鐵;利用14H++Cr2O72-+6Fe2+═2Cr3++6Fe3++7H2O、SO2+2Fe3++2H2O=SO42-+2Fe2++4H+,可知,3SO2~Cr2O72-,以此計算.
解答 解:銅礦與S在高溫下煅燒,使其轉變為FeS2、CuS,加入HCl、NaCl、CuCl2混合溶液 發生反應Cu2++CuS+4Cl-=2[CuCl2]-+S↓,過濾得到濾液中通入空氣發生反應4CuCl2-+O2+4H+=4Cu2++8Cl-+2H2O,一定溫度下,在反應Ⅲ所得的溶液中加入稀硫酸,可以析出硫酸銅晶體,結晶分離得到硫酸銅晶體,加入鐵還原溶液得到銅;濾渣分離得到FeS和S,FeS2通入空氣灼燒得到氧化鐵和二氧化硫,氧化鐵煉鋼,二氧化硫制備硫酸,
(1)由流程可知,黃鐵礦分解生成的Fe、Cu均為+2價,則反應I的產物為FeS2、CuS,
故答案為:FeS2、CuS;
(2)反應Ⅲ中生成銅離子,則離子反應為4CuCl2-+O2+4H+═4Cu2++8Cl-+2H2O,
故答案為:4CuCl2-+O2+4H+═4Cu2++8Cl-+2H2O;
(3)相同條件下硫酸銅的溶解度小,則該溫度下,硫酸銅的溶解度小于氯化銅,所以向反應Ⅲ所得的溶液中加入稀硫酸,可以析出硫酸銅晶體,
故答案為:該溫度下,硫酸銅的溶解度小于氯化銅、加入硫酸,有利于析出硫酸銅晶體;
(4)煉鋼時為了降低含碳量,可將鐵紅投入熔融的生鐵中,氧化鐵和碳反應生成鐵和一氧化碳,反應的化學方程式為:3C+Fe2O3$\frac{\underline{\;高溫\;}}{\;}$ 2Fe+3CO↑,
故答案為:3C+Fe2O3$\frac{\underline{\;高溫\;}}{\;}$ 2Fe+3CO↑;
(5)二氧化硫中硫元素化合價+4價,處于硫元素的中間價態,表現氧化性可以利用二氧化硫和硫化氫反應生成淡黃色沉淀硫單質,反應的化學方程式為:SO2+2H2S=3S↓+2H2O,NaHSO3、NH4HSO3,其水溶液均呈酸性,亞硫酸氫鈉溶液中亞硫酸氫根離子電離程度大于其水解程度,亞硫酸氫銨溶液中銨根離子水解程度大于亞硫酸氫根水解程度溶液顯酸性,相同條件下,同濃度的兩種水溶液中c(SO32-)較小的是NH4HSO3,
故答案為:SO2+2H2S=3S↓+2H2O; NH4HSO3;
(6)利用14H++Cr2O72-+6Fe2+═2Cr3++6Fe3++7H2O、SO2+2Fe3++2H2O=SO42-+2Fe2++4H+,
可知,3SO2~Cr2O72-,
3 1
x 0.02mol/L×0.025L
解得x=0.0015mol,
反應Ⅳ所得氣體中SO2的體積分數為:$\frac{0.0015mol}{\frac{0.28L}{22.4L/mol}}$×100%=12.00%,
故答案為:12.00%.
點評 本題以實際化工生產“黃銅礦的綜合利用”為背景,考查了元素化合物知識,離子方程式和化學方程式的書寫及有關計算,題目更注重考查學生利用化學原理來解決實際問題的能力,利用關系式計算可簡化計算,題目難度中等.


 靈星計算小達人系列答案
靈星計算小達人系列答案科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
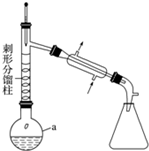
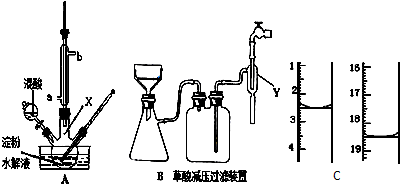
 (1)實驗室用如圖所示裝置制備少量乙酸乙酯.
(1)實驗室用如圖所示裝置制備少量乙酸乙酯.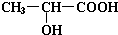 .試回答:
.試回答: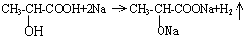 ;
;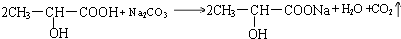 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
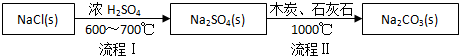
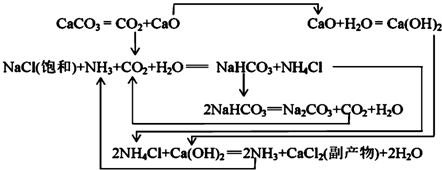
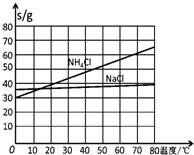
| NaCl | NH4Cl | NaHCO3 | NH4HCO3 | Na2CO3 |
| 35.9 | 37.2 | 9.6 | 21.7 | 21.5 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題

| 物質 | 熔點/℃ | 沸點/℃ | 溶解性 |
| 乙酰苯胺 | 114.3 | 305 | 微溶于冷水,易溶于熱水 |
| 苯胺 | -6 | 184.4 | 微溶于水 |
| 醋酸 | 16.6 | 118 | 易溶于水 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 化學反應中的能量變化,通常表現為熱量的變化 | |
| B. | 常溫下氫氧化鋇晶體與氯化銨晶體混合放出氨氣,該反應為放熱反應 | |
| C. | 酸堿反應生成1 mol水所發出的熱量為中和熱 | |
| D. | 舊化學鍵斷裂所放出的能量高于新化學鍵形成所吸收的能量時發生放熱反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1 000 mL容量瓶,58.5 g NaCl | B. | 980 mL容量瓶,57.3 g NaCl | ||
| C. | 500 mL容量瓶,58.5 gNaCl | D. | 1 000 mL容量瓶,117.0 g NaC1 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com