
化還原反應在生產、生活中具有廣泛的用途,貫穿古今。
(1)下列生產、生活中的事例中發生了氧化還原反應的是( )

(2)水是人體的重要組成部分,是人體中含量最多的一種物質。而“四種基本反應類型與氧化還原反應的關系”也可用如圖表達。

試寫出有水參加、水為還原劑且為類型Ⅳ的一個化學方程式:_ _
(3)NaNO2是一種食品添加劑,它能致癌。酸性KMnO4溶液與NaNO2的反應離子方程式是
![]() MnO4-+ NO2-+ ===== Mn2++ NO3-+ H2O
MnO4-+ NO2-+ ===== Mn2++ NO3-+ H2O
Ⅰ、請補充完整,配平方程式并標出電子轉移方向和數目
Ⅱ、某同學稱取了7.9 g KMnO4固體,欲配制100 mL溶液。回答下列問題:
該實驗中,使用容量瓶時要檢查是否漏水,其操作是: 。
Ⅲ、不規范的實驗操作會導致實驗結果的誤差。分析下列操作對實驗結果的影響偏小 (請填序號) :
① 在溶解過程中有少量液體濺出燒杯外
② 定容時仰視儀器上的刻度線
③ 定容后,將容量瓶振蕩搖勻后,靜置發現液面低于刻度線,于是又加入少量水至刻度線
IV、最后所得的溶液應存放在試劑瓶中,并貼上標簽,請你填寫該標簽(如圖)。

V、某同學用上述配好的KMnO4溶液滴定末知濃度的NaNO2溶液:
取20mL末知濃度的NaNO2溶液于錐形瓶;
取上述配好的KMnO4溶液于 (“酸式”或“堿式”)滴定管
滴定完成后消耗KMnO4溶液10mL則NaNO2溶液的濃度為
 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:閱讀理解
| ||
| ||








查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
| ||
查看答案和解析>>
科目:高中化學 來源:2012-2013學年湖北省襄陽市高三元月第一次調研考試理綜化學試卷(解析版) 題型:填空題
近年來,為提高能源利用率,西方提出共生理念——為提高經濟效益,人類生產活動盡可能多功能化.共生工程將會大大促進化學工業的發展.
(1)由于共生工程的應用,利用發電廠產生的SO2制成自發電池,其電池反應方程式為:2SO2+O2+2H2O=2H2SO4,該電池電動勢為1.06V.實際過程中,將SO2通入電池的 極(填“正”或“負”),負極反應式為 .用這種方法處理SO2廢氣的優點是 .
(2)以硫酸工業的SO2尾氣、氨水、石灰石、焦炭、碳酸氫銨和氯化鉀等為原料,可以合成有重要應用價值的硫化鈣、硫酸鉀、亞硫酸銨等物質.合成路線如下:
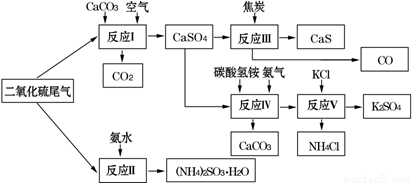
①生產中,向反應Ⅱ中的溶液中加入適量還原性很強的對苯二酚等物質,其目的是 .
②下列有關說法正確的是 .
A.反應Ⅰ中需鼓入足量空氣,以保證二氧化硫充分氧化生成硫酸鈣
B.反應Ⅲ中發生反應的化學方程式為CaSO4+4C  CaS+4CO↑
CaS+4CO↑
C.反應Ⅳ需控制在60~70℃,目的之一是減少碳酸氫銨的分解
D.反應Ⅴ中的副產物氯化銨可用作氮肥
③反應Ⅴ中選用了40%的乙二醇溶液做溶劑,溫度控制在25℃,此時硫酸鉀的產率超過90%,選用40%的乙二醇溶液做溶劑的原因是 .
④(NH4)2SO3可用于電廠等煙道氣中脫氮,將氮氧化物轉化為氮氣,同時生成一種氮肥,形成共生系統.寫出二氧化氮與亞硫酸銨反應的化學方程式 .
查看答案和解析>>
科目:高中化學 來源: 題型:
純三氟化氮(NF3)在集成電路、大型屏幕液晶顯示屏(TFT-LCD)的生產中,作為清洗劑之用。
三氟化氮在潮濕的空氣中與水蒸氣能發生氧化還原反應,其反應的產物有:HF、NO和HNO3,請根據要求回答下列問題:
(1)寫出該反應的化學方程式。 。
(2)NF3是一種無色、無臭的氣體,但一旦NF3在空氣中泄漏,還是易于發現。你判斷該氣體泄漏時的現象是 。
(3)一旦NF3泄漏,可以用噴淋 溶液的方法減少污染。
(4)一種生產NF3的方法:氟氣與液態氟化氫銨(NH4HF2)反應,產生NF3。
寫出該反應的化學方程式:
查看答案和解析>>
科目:高中化學 來源: 題型:
純三氟化氮(NF3)在集成電路、大型屏幕液晶顯示屏(TFT-LCD)的生產中,作為清洗劑之用。三氟化氮在潮濕的空氣中與水蒸氣能發生氧化還原反應,其反應的產物有:HF、NO和HNO3,請根據要求回答下列問題:
(1)NF3的電子式為 。
(2)寫出該反應的化學方程式。 。
(3)NF3是一種無色、無臭的氣體,但一旦NF3在空氣中泄漏,還是易于發現。你判斷該氣體泄漏時的現象是 。
(4)一旦NF3泄漏,可以用噴淋 溶液的方法減少污染。
(5)一種生產NF3的方法:氟氣與液態氟化氫銨(NH4HF2)反應,產生NF3。寫出該反應的化學方程式:
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com