
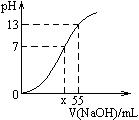
 常溫時,用1.0 mol·L–1的NaOH溶液滴定某濃度的H2SO4溶液,溶液pH的變化曲線如右圖。由圖可知:
常溫時,用1.0 mol·L–1的NaOH溶液滴定某濃度的H2SO4溶液,溶液pH的變化曲線如右圖。由圖可知:
⑴硫酸溶液的物質的量濃度為 。
⑵圖中x的數值為 mL。
科目:高中化學 來源: 題型:
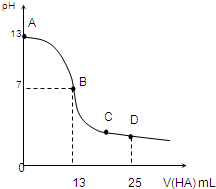 常溫下,向25mL 0.1mol/L MOH溶液中逐滴加入0.2mol/L HA溶液,曲線如圖所示(體積變化忽略不計).回答下列問題:
常溫下,向25mL 0.1mol/L MOH溶液中逐滴加入0.2mol/L HA溶液,曲線如圖所示(體積變化忽略不計).回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
(17分)利用催化氧化反應將SO2轉化為SO3是工業上生產硫酸的關鍵步驟。
(1)某溫度下,2SO2(g)+O2(g) 2S03(g)△H3=mkJ/mol,平衡常數(K)的大小與溫度(T)的關系如右圖中曲線所示,則m____0(填“>”“=”或“<”);b點時v(正) v(逆)(填“<”、“=”或“>”)。反應的焓變(△H)將 (填“增大”、“減小”或“不變”)。
2S03(g)△H3=mkJ/mol,平衡常數(K)的大小與溫度(T)的關系如右圖中曲線所示,則m____0(填“>”“=”或“<”);b點時v(正) v(逆)(填“<”、“=”或“>”)。反應的焓變(△H)將 (填“增大”、“減小”或“不變”)。
(2)若反應物起始的物質的量相同,下列關系圖不正確的是 (填序號)。
(3)某硫酸廠利用SO2尾氣、廢鐵屑、空氣、水合成綠礬(FeS04·7H2O),反應中作還原劑的物質是 。
(4)將反應后的混合氣體用氨水吸收可得到(NH4)2SO3和(NH4)2SO4兩種化工原料。
①對于(NH4)2SO3溶液,某同學寫出了如下的正確關系式:
2[c(SO2-3)十c(HSO-3)+c(H2SO3)]=c(NH+4)+c(NH3·H2O)
請分析該同學的依據是 。
②在(NH4)2 SO4溶液中存在:NH+4+H2O NH3·H2O+H+,則該反應常溫下的平衡常數K= (已知:常溫下,NH3·H2O的電離平衡常數K=1. 7×10-5)
NH3·H2O+H+,則該反應常溫下的平衡常數K= (已知:常溫下,NH3·H2O的電離平衡常數K=1. 7×10-5)
(5)三氧化硫吸收后所得的硫酸常用來制備BaSO4作X射線透視時的內服造影劑,胃酸很強(pH約為1),但服用大量BaSO4仍然是安全的,BaSO4不溶于酸的原因是(用溶解平衡原理解釋) 。萬一誤服了少量BaCO4,應盡快用大量0. 5mol/LNa2SO4溶液給患者洗胃,如果忽略洗胃過程中Na2SO4溶液濃度的變化,殘留在胃液中的Ba2+濃度僅為mol/L(已知25℃時,Ksp(BaSO4)=1×l0-10 ,Ksp(BaCO3)=1×10-9).
查看答案和解析>>
科目:高中化學 來源:2011-2012學年浙江省杭州市高三上學期期中七校聯考化學試卷 題型:填空題
(16分)下表為元素周期表的一部分,請用化學用語回答下列問題:
|
族 周期 |
IA |
|
0 |
|||||
|
1 |
① |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
|
2 |
|
|
|
② |
③ |
④ |
|
|
|
3 |
⑤ |
|
⑥ |
⑦ |
|
⑧ |
⑨ |
|
(1)④、⑤、⑥的原子半徑由大到小的順序為_________________ ___(用元素符號表示)。
(2)請用化學方程式表示非金屬性:②>⑦ _______ ____
(3)表中①、④兩種元素的原子可按1:1組成一種具有二元弱酸性質的物質,請寫出該物質
的電離方程式: 該弱酸性物質與⑤的最高價氧化物對應的水化物反應時可生成一種酸式鹽,該酸式鹽的電子式:
(4)由表中元素形成的常見物質X、Y、Z、M、N可發生以下反應:

A.X溶液與Y溶液反應的離子方程式為______________ _______,
B.N→⑥的單質的化學方程式為____________ ____。
C.常溫下,為了使0.1 mol/L M 溶液中由M電離出的陰、陽離子濃度相等,應向溶液中加入一定量的Y溶液至_____________ ____。
(5)由④、⑤、⑧三中元素形成的化合物溶液中,加入鹽酸發生氧化還原反應的離子方程式是 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com