
| A. | 氨氣能使?jié)駶櫟乃{色石蕊試紙變?yōu)榧t色 | |
| B. | N2中有少量的雜質(zhì)CO,可將混合氣體通過灼熱的氧化銅除去CO | |
| C. | 200mL3mol.L-1BaCl2溶液跟100mL3mol.L-1KCl溶液混合后,溶液中c(Cl-)仍然是3 mol/L | |
| D. | 溶液、濁液、膠體的本質(zhì)區(qū)別是粒子直徑的大小不同 |
分析 A.濕潤的紅色色石蕊試紙遇到堿變藍;
B.氮氣性質(zhì)穩(wěn)定,一氧化碳少量,在氮氣氛圍中一氧化碳難與氧化銅反應;
C.兩溶液中氯離子的濃度不相同;
D.根據(jù)三類分散系的本質(zhì)差異是分散質(zhì)粒子的大小解答.
解答 解:A.氨氣是堿性氣體,能使?jié)駶櫟募t色色石蕊試紙變藍,故A正確;
B.氮氣性質(zhì)穩(wěn)定,一氧化碳少量,在氮氣氛圍中一氧化碳難與氧化銅反應,故B錯誤;
C.3mol•L-1的BaCl2溶液中氯離子濃度為6mol•L-1,3mol•L-1的KCl溶液中氯離子濃度為L3mol•L-1,混合后氯離子濃度,介于之間3mol•L-1~6mol•L-1,故C錯誤;
D.根據(jù)分散質(zhì)粒子直徑大小來分類,把分散系劃分為:溶液(小于1nm)、膠體(1nm~100nm)、濁液(大于100nm).所以,溶液、膠體和濁液這三種分散系的本質(zhì)的區(qū)別在于分散質(zhì)粒子直徑大小,故D正確;
故選:D.
點評 本題考查了元素化合物知識,熟悉氨氣、氮氣的性質(zhì),熟悉分散系分類依據(jù)是解題關鍵,題目難度不大.


科目:高中化學 來源: 題型:解答題

| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 開始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 硫代硫酸鈉(Na2S2O3•5H2O)是一種脫氯劑,它易溶于水,難溶于乙醇,40~45℃熔化,48℃分解,由硫化鈉和亞硫酸鈉制備,涉及的反應原理為:
硫代硫酸鈉(Na2S2O3•5H2O)是一種脫氯劑,它易溶于水,難溶于乙醇,40~45℃熔化,48℃分解,由硫化鈉和亞硫酸鈉制備,涉及的反應原理為: .
.查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 2A+3B=2C | B. | A+3B=2C | C. | 3A+B=2C | D. | A+B=C |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 鈉與水反應:Na+2H2O═Na++2OH-+H2↑ | |
| B. | Na2O2 溶于水產(chǎn)生O2:Na2O2+H2O═2Na++2OH-+O2↑ | |
| C. | 大理石溶于醋酸:CaCO3+2H+═Ca2++CO2↑+H2O | |
| D. | Ca(HCO3)2溶液與少量NaOH溶液反應:HCO3-+Ca2++OH-═CaCO3↓+H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
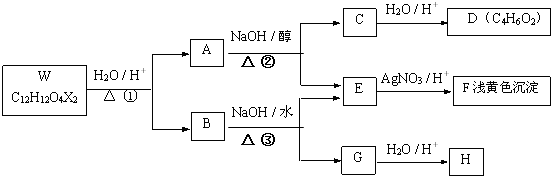

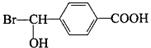
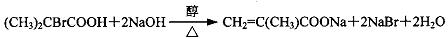
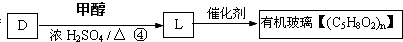 ,反應④的化學方程式是
,反應④的化學方程式是
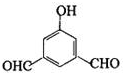 、
、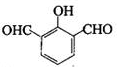 、
、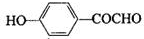 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 3,3-二甲基-1-丁烯在一定條件下與氫氣充分反應后得到3,3-二甲基丁烷 | |
| B. | 工業(yè)生產(chǎn)中用乙醇與氫氧化鈉作用生成乙醇鈉,故乙醇可以與氫氧化鈉溶液反應 | |
| C. | 地球上最基本的能源是太陽能,植物通過光合作用吸收太陽能,被吸收的太陽能通過各種形式的化學反應轉化為化學能,物質(zhì)中的化學能又可以通過各種形式的化學反應轉化為熱能、光能或電能 | |
| D. | 道爾頓、湯姆生、盧瑟福、波爾和門捷列夫等科學家對原子結構模型的建立均作出了卓越的貢獻 |
查看答案和解析>>
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com