

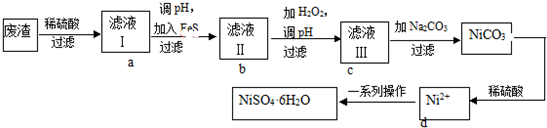
| 實驗編號 | 反應物 | 催化劑 |
| ① | 10mL 2% H2O2溶液 | 無 |
| ② | 10mL 5% H2O2溶液 | 無 |
| ③ | 10mL 5% H2O2 溶液 | 0.1gMnO2粉末 |
| ④ | 10mL 5% H2O2 溶液+少量HCl溶液 | 0.1gMnO2粉末 |
| ⑤ | 10mL 5% H2O2 溶液+少量NaOH溶液 | 0.1gMnO2粉末 |
| 第一次 | 第二次 | 第三次 | 第四次 | |
| 體積(mL) | 17.10 | 18.10 | 18.00 | 17.90 |
分析 (1)乙基蒽醌作催化劑,氫氣和氧氣反應生成雙氧水;
(2)i.過氧化氫是弱電解質屬于二元弱酸分部電離;ii.過氧化氫具有漂白性;
(3)i.實驗①和②的濃度不同;為了便于比較,應在相同的條件下利用一個變量來比較;
ii、由圖可知,⑤的反應速率最大,④的反應速率最小,以此來解答;
(4)i.據氧化還原反應中得失電子守恒和原子守恒配平方程式;
ii.第一次滴定體積和其它三次差距過大,應該舍去,求出第二、三、四三次的平均值,根據反應求出過氧化氫的濃度;
iii.滴定前有氣泡,消耗的高錳酸鉀偏多,測定結果偏高.
解答 解:(1)通過圖示可知,用乙基蒽醌作催化劑制取雙氧水,反應為:H2+O2$\frac{\underline{\;催化劑\;}}{\;}$H2O2,
故答案為:H2+O2$\frac{\underline{\;催化劑\;}}{\;}$H2O2;
(2)i.過氧化氫是弱電解質,H2O2溶液顯酸性屬于二元弱酸分部電離,電離的方程式為:H2O2?H++HO2- HO2-?H++O22-;
故答案為:H2O2?H++HO2- HO2-?H++O22-;
ii.過氧化氫具有漂白性,能夠將pH試紙的紅色漂白至百色,所以需用pH計測定其pH,
故答案為:D;
(3)i.實驗①和②的濃度不同,則該實驗的目的為探究濃度對化學反應速率的影響;為了便于比較,應在相同的條件下利用一個變量來比較,
則向反應物中加入等量同種催化劑(或將盛有反應物的試管放在同一熱水浴中),
故答案為:探究濃度對反應速率的影響;向反應物中加入等量同種催化劑(或將盛有反應物的試管放在同一熱水浴中);
ii.由圖可知,⑤的反應速率最大,④的反應速率最小,結合實驗方案可知,堿性環境能增大H2O2分解的速率,酸性環境能減小H2O2分解的速率,即:溶液pH越大,雙氧水分解速度越快,
故答案為:溶液pH越大,雙氧水分解速度越快;
(4)i.每有1molMnO4-反應得電子5mol,每有1molH2O2反應,失電子2mol,所以高錳酸根和過氧化氫的物質的量之比為2:5,其化學計量數分別為2、5,在據原子守恒,得出錳離子和氧分子前的化學計量數也是2和5,再據電荷守恒配平氫離子為6,據H原子守恒,水的化學計量數為8,化學方程式為:2MnO4-+5H2O2+6H+═2Mn2++8H2O+5O2↑,
故答案為:2MnO4-+5H2O2+6H+═2Mn2++8H2O+5O2↑;
ii.由于第一次數據誤差過大,故舍去;其它三組的平均值為 18.00ml,根據反應2MnO4-+5H2O2+6H+═2Mn2++8H2O+5O2,n(H2O2)=2.5×n(MnO4-)=2.5×0.1000mol•L-1×0.018L,c(H2O2)=$\frac{2.5×0.1×0.018}{0.025}$=0.18 mol/L,
故答案為:0.18;
iii.滴定前尖嘴中有氣泡,導致消耗的標準液偏大,測定結果偏高,
故答案為:偏高.
點評 本題考查影響化學反應速率因素、化學方程式書寫、電離方程式書寫等知識,題目難度中等,試題知識點較多、綜合性較強,能夠較好的考查學生實驗設計、數據處理、圖象分析的綜合能力.


科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源:2016-2017學年湖北省高二上月考一化學卷(解析版) 題型:選擇題
向密閉容器中充入物質A和B,發生反應aA(g)+bB(g)  cC(g)。反應過程中,物質A的含量(A%)和C的含量(C%)隨溫度(T)的變化曲線如圖所示,下列說法正確的是
cC(g)。反應過程中,物質A的含量(A%)和C的含量(C%)隨溫度(T)的變化曲線如圖所示,下列說法正確的是
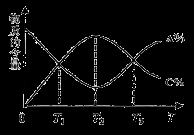
A.該反應在T1、T3溫度時達到過化學平衡 B.該反應在T2溫度時達到過化學平衡
C.該反應的逆反應是放熱反應 D.升高溫度,平衡會向正反應 方向移動
方向移動
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
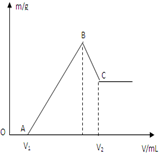 將0.1molMg、Al混合物溶于100mL4mol/L的鹽酸中,然后再滴加1mol/L的NaOH溶液,在滴加NaOH溶液的過程中,沉淀質量m與NaOH溶液的體積V的變化如圖所示.
將0.1molMg、Al混合物溶于100mL4mol/L的鹽酸中,然后再滴加1mol/L的NaOH溶液,在滴加NaOH溶液的過程中,沉淀質量m與NaOH溶液的體積V的變化如圖所示.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 測定某補血劑(成分FeSO4和維生素C)中鐵元素的含量,將一定質量的補血劑溶于水,然后用標準濃度的酸性高錳酸鉀溶液滴定至溶液恰好變紫色且半分鐘不改變 | |
| B. | 測量SO2、N2混合氣體中SO2含量,將標準狀況下一定體積混合氣體通過裝有一定濃度一定體積的碘-淀粉溶液的反應直至溶液藍色恰好消失 | |
| C. | 測定氯化銨與硫酸銨混合物中氯化銨的含量,將一定質量的混合物溶于水,再加入過量氯化鋇溶液至沉淀不再生成,過濾、洗滌、干燥,再稱重 | |
| D. | 測定硫酸銅晶體(CuSO4•xH2O)里結晶水的含量,將一定質量的硫酸銅晶體加熱至藍色變白,冷卻,稱量,重復至前后質量恒定 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | CH4(C2H4):酸性高錳酸鉀溶液 | |
| B. | NaHCO3溶液(少量Na2CO3):通入足量的CO2氣體 | |
| C. | 苯(混有Br2):加NaOH溶液洗滌、靜置、分液 | |
| D. | FeCl3溶液(FeCl2):通入適量氯氣 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 乙烯使溴的四氯化碳溶液褪色 | B. | 由乙酸制乙酸乙酯 | ||
| C. | 乙烯使酸性高錳酸鉀溶液褪色 | D. | 甲烷與氯氣在光照條件下發生反應 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com