

 .
.| 實驗現象 | 原因 |
| 溶液最初從紫色逐漸變為紅色 | 氯氣與水反應生成的H+使石蕊變色 |
| 隨后溶液逐漸變為無色 | _氯氣與水反應生成的HClO將石蕊氧化為無色物質 |
| 然后溶液從無色逐漸變為淺黃綠色 | 繼續通入的氯氣溶于水使溶液呈淺黃綠色 |
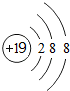
分析 (l)鉀離子核內有19個質子,核外有18個電子,每層上的電子數為2、8、8,據此畫離子結構示意圖;
(2)實驗室中用濃鹽酸與二氧化錳加熱反應制取氯氣,氯氣中含有氯化氫雜質,可用飽和食鹽水除去氯氣中的氯化氫氣體;
(3)由題目信息可知,在加熱條件下,氯氣與濃KOH溶液反應生成氯酸鉀,在常溫以下,氯氣與稀NaOH溶液反應生成次氯酸鈉;分離固體與液體通常采用過濾的方法;②的試管中有大量晶體析出,說明溶質的溶解度隨溫度的降低而降低,據此進行判斷;
(4)本實驗中用氯氣與8% NaOH 溶液,并置于冰水浴中,制取次氯酸鈉,據此書寫離子方程式;
(5)氯氣與水反應生成鹽酸和次氯酸,反應生成的H+使石蕊變成紅色,次氯酸具有強氧化性,將石蕊氧化為無色物質;氯氣溶于水后呈淺黃綠色;
解答 解:(l)鉀離子核內有19個質子,核外有18個電子,每層上的電子數為2、8、8,鉀離子結構示意圖為 ,
,
故答案為: ;
;
(2)實驗室中用濃鹽酸與二氧化錳加熱反應制取氯氣,氯氣中含有氯化氫雜質,可用飽和食鹽水除去氯氣中的氯化氫氣體,用飽和食鹽水除去氯氣中的氯化氫氣體,故在①與②之間安裝盛有飽和食鹽水的洗氣瓶,所以B正確,
故選B;
(3)根據題中信息可知,在加熱條件下,氯氣與濃KOH溶液反應生成氯酸鉀,在常溫以下,氯氣與稀NaOH溶液反應生成次氯酸鈉,二者反應的濃度和溫度都不相同;不溶性固體與液體的分離常采用過濾的方法,反應完畢經冷卻后,②的試管中有大量晶體析出,說明溶質的溶解度隨溫度的降低而降低,只有M符合,
故答案為:制取溫度不同、制取時堿的濃度也不同;過濾;M;
(4)本實驗中用氯氣與8% NaOH 溶液,并置于冰水浴中,制取次氯酸鈉,反應的離子方程式為Cl2+2OH-=Cl-+ClO-+H2O,
故答案為:Cl2+2OH-=Cl-+ClO-+H2O;
(5)氯氣與水反應生成鹽酸和次氯酸,反應生成的H+使石蕊變成紅色;氯氣與水反應生成的HClO,次氯酸具有強氧化性,將石蕊氧化為無色物質;多余的氯氣溶于水,使溶液呈淺黃綠色,
故答案為:
| 紅 | |
| 氯氣與水反應生成的HClO將石蕊氧化為無色物質 | |
| 淺黃綠 | 繼續通入的氯氣溶于水使溶液呈淺黃綠色 |
點評 本題考查對裝置的分析評價、物質的分離提純、對實驗現象的分析等知識點,試題難度中等,該類試題綜合性強,難易適中,有利于培養學生的邏輯推理能力和規范嚴謹的實驗設計能力;該類試題主要是以常見儀器的選用、實驗基本操作為中心,重點考查實驗基本操作的規范性和準確及靈活運用知識解決實際問題的能力.


科目:高中化學 來源: 題型:選擇題
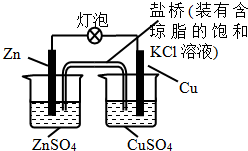
| A. | 一段時間后,銅棒上有紅色物質析出 | |
| B. | 正極反應為:Zn-2e-=Zn2+ | |
| C. | 在外電路中,電流從鋅棒流向銅棒 | |
| D. | 鹽橋中的K+移向ZnSO4溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
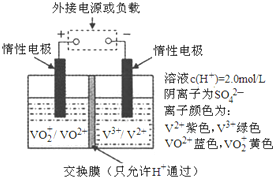 釩(V)及其化合物廣泛應用于工業催化、新材料和新能源等領域.
釩(V)及其化合物廣泛應用于工業催化、新材料和新能源等領域.
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 直接用酒精噴燈加熱 | B. | KMnO4、鋁條 | ||
| C. | 火柴頭、濃鹽酸 | D. | KMnO4、鞭炮引線 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com