
分析 (1)根據熱化學方程式利用蓋斯定律計算反應熱并書寫熱化學方程式,已知:①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H1=-1274.0kJ/mol
②2CO(g)+O2(g)═2CO2(g)△H2=-566.0kJ/mol
③H2O(g)═H2O(l)△H3=-44kJ/mol.
依據蓋斯定律計算(①-②+③×4)×$\frac{1}{2}$得到甲醇不完全燃燒生成一氧化碳和液態水的熱化學方程式;
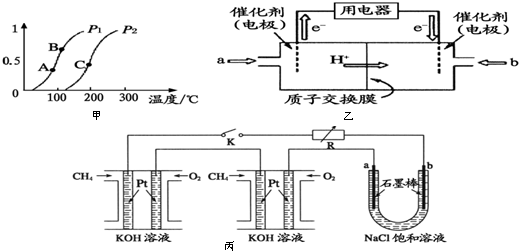
(2)①在200℃時,看不同壓強下CO的轉化率大小,結合化學方程式中反應前后氣體的體積變化解答;正反應吸熱,隨溫度升高,平衡正向移動,化學平衡常數K增大;
②可逆反應達到平衡狀態時,正逆反應速率相等各組分濃度保持不變;
(3)根據圖知,交換膜是質子交換膜,則電解質溶液呈酸性,根據氫離子移動方向知,通入a的電極為負極、通入b的電極為正極,負極上甲醇失去電子發生氧化反應;
(4)電解氯化鈉溶液的化學方程式為2NaCl+2H2O$\frac{\underline{\;通電\;}}{\;}$2NaOH+H2↑+Cl2↑,可知關系式1 mol CH4~8 mol e-~8molNaOH計算.
解答 解:(1)已知:①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H1=-1274.0kJ/mol
②2CO(g)+O2(g)═2CO2(g)△H2=-566.0kJ/mol
③H2O(g)═H2O(l)△H3=-44kJ/mol.
依據蓋斯定律計算(①-②+③×4)×$\frac{1}{2}$得到甲醇不完全燃燒生成一氧化碳和液態水的熱化學方程式為:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442KJ/mol,
故答案為:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442KJ/mol;
(2)①在圖a的200℃位置,平行與縱軸畫一條虛線,可見CH4的轉化率P1>P2,在CH4(g)+H2O(g)?CO(g)+3H2(g)反應中,生成物的氣體體積大于反應物,壓強增大時平衡向逆向移動,故P1<P2,正反應吸熱,隨溫度升高,平衡正向移動,化學平衡常數K增大,所以KA<KB<KC,
故答案為:<;KA<KB<KC;
②可逆反應達到平衡狀態時,正逆反應速率相等各組分濃度保持不變,
a.反應前后氣體體積不同,所以容器的壓強恒定時反應達到平衡狀態,故a正確;
b.容器體積不變,氣體質量不變,所以容器內氣體密度始終恒定,故b錯誤;
c.3v正(CH4)=v逆(H2),說明正逆反應速率相等,反應達到平衡狀態,故c正確;
d.單位時間內消耗0.1molCH4同時生成0.3molH2,都是正反應速率,不能說明反應達到平衡狀態,故d錯誤;
故答案為:ac;
(3)根據圖知,交換膜是質子交換膜,則電解質溶液呈酸性,根據氫離子移動方向知,通入a的電極為負極、通入b的電極為正極,負極上甲醇失去電子發生氧化反應,負極反應式為 CH3OH-6e-+H2O=CO2+6H+,正極上氧氣得電子發生還原反應,電極反應式為O2+4e-+4H+=2H2O,
故答案為:負;CH3OH-6e-+H2O=CO2+6H+;
(4)電解氯化鈉溶液的化學方程式為2NaCl+2H2O$\frac{\underline{\;通電\;}}{\;}$2NaOH+H2↑+Cl2↑,可知關系式1 mol CH4~8 mol e-~8molNaOH,故若每個電池甲烷通入量為0.224L(標準狀況),生成0.08molNaOH,c(NaOH)=$\frac{0.08mol}{0.8L}$=0.1mol/L,pH=13;電解池通過的電量為$\frac{0.224L}{22.4L/mol}$×8×9.65×104C•mol-1=7.72×103C(題中雖然有兩個燃料電池,但電子的傳遞量只能用一個池的甲烷量計算),
故答案為:$\frac{0.224L}{22.4L/mol}$×8×9.65×104C•mol-1=7.72×103C;13.
點評 本題涵蓋熱化學、電化學主體內容,涉及電極判斷與電極反應式書寫等問題,做題時注意從氧化還原的角度判斷原電池的正負極以及電極方程式的書寫,本題中難點和易錯點為電極方程式的書寫,題目難度中等.


科目:高中化學 來源: 題型:選擇題
| A. | 3個 | B. | 4個 | C. | 5個 | D. | 6個 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
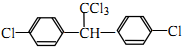 .下列有關DDT的說法正確的是( )
.下列有關DDT的說法正確的是( )| A. | 它屬于芳香烴 | B. | 分子中最多有23個原子共平面 | ||
| C. | 分子式為C14H9Cl5 | D. | 能發生水解反應和消去反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
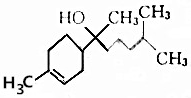
| A. | 分子式為C15H26O | B. | 能和NaHCO3溶液反應生成CO2 | ||
| C. | 不能使酸性高錳酸鉀溶液褪色 | D. | 能與乙酸發生取代反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 電解飽和食鹽水時,當溶液pH由7變為13,電路中轉移的電子數為0.1NA | |
| B. | 標準狀況下,35.5 g 氯氣與足量紅熱的鐵充分反應得到的電子數一定為NA | |
| C. | 標準狀況下,2.24 L HF中含有的原子數為0.2NA | |
| D. | 在密閉容器中加入0.5 moL N2和1.5 moL H2,充分反應后容器中的N-H鍵數為3NA |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
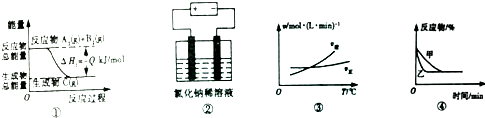
| A. | 圖①表示可逆反應A2(g)+B2(g)?C(g)的△H1大于0 | |
| B. | 圖②是電解氯化鈉稀溶液的電解池,其中陰、陽極產生氣體的體積之比一定為1:1 | |
| C. | 圖③表示可逆反應A2(g)+3B2(g)?2AB3(g)的△H小于0 | |
| D. | 圖④表示壓強對可逆反應2A(g)+2B(g)?3C(g)+D(s)的影響,乙曲線對應的壓強大 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com