
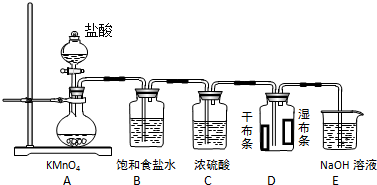
分析 (1)分析元素中化合價變化,依據氧化還原反應得失電子守恒、原子個數守恒配平方程式;
(2)依據方程式2KMnO4+16HCl(濃)=2KCl+2MnCl2+5Cl2↑+8 H2O可知,生成1mol氯氣,有2mol氯化氫中-1價氯化合價升高,失去2mol電子,據此計算轉移0.5mol電子,則生成Cl2的物質的量;
(3)濃硫酸具有吸水性;
(4)氯氣不具有漂白性,次氯酸具有漂白性;
(5)氯氣與氫氧化鈉反應生成氯化鈉、次氯酸鈉和水;
(6)配制500mL溶液,應選擇500ml容量瓶,依據m=CVM計算需要氫氧化鈉的質量.
解答 解:(1)反應中高錳酸鉀中+7價錳降為氯化錳中+2價,氯化氫中-1價氯部分升高為氯氣中0價,依據得失電子守恒,則氯氣系數為5,高錳酸鉀系數為2,依據原子個數守恒,反應方程式:2KMnO4+16HCl(濃)=2KCl+2MnCl2+5Cl2↑+8 H2O;
故答案為:2;16;2;2;5;8;
(2)依據方程式2KMnO4+16HCl(濃)=2KCl+2MnCl2+5Cl2↑+8 H2O可知,生成1mol氯氣,有2mol氯化氫中-1價氯化合價升高,失去2mol電子,據此計算轉移0.5mol電子,則生成Cl2的物質的量0.25mol;
故答案為:0.25mol;
(3)濃硫酸具有吸水性,可以干燥氯氣;
故答案為:干燥氯氣;
(4)氯氣不具有漂白性,氯氣與水反應生成的次氯酸具有漂白性,所以看到干燥的布條不褪色,濕潤的布條褪色;
故答案為:干布條不褪色,濕布條褪色;
(5)氯氣與氫氧化鈉反應生成氯化鈉、次氯酸鈉和水,離子方程式:Cl2+2OH-=Cl-+ClO-+H2O;
故答案為:Cl2+2OH-=Cl-+ClO-+H2O;
(6)配制500mL溶液,應選擇500ml容量瓶,需稱量的NaOH的質量=0.5mol•L-1×0.5L×40g/mol=10.0g,
故答案為:500 mL容量瓶;10.0 g.
點評 本題考查了氯氣的實驗室制備和性質的檢驗,一定物質的量濃度溶液的配制,明確氯氣的制備原理和性質是解題關鍵,題目難度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Na2O2+2H2O═2Na++2OH-+H2↑ | B. | 2O22-+4H+═4OH-+O2↑ | ||
| C. | Na2O2+2H2O═2Na++2OH-+O2↑ | D. | 2Na2O2+2H2O═4Na++4OH-+O2↑ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
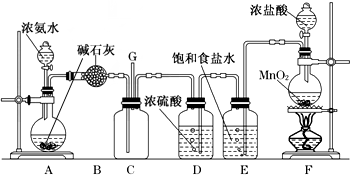
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
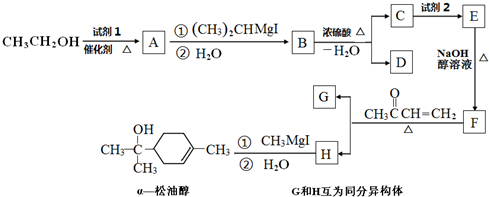
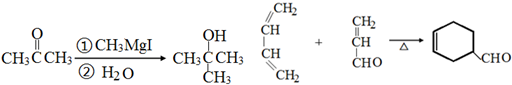
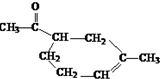 .
.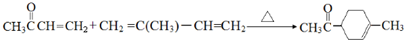 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
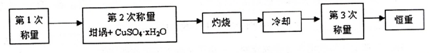

| 加熱前質量 | 加熱后質量 | ||
| m1 | m2 | m3 | m4 |
| 11.721g | 22.692g | 18.631g | a |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com