
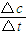 結合反應速率之比等于化學質量數之比計算反應速率;
結合反應速率之比等于化學質量數之比計算反應速率;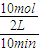 =0.5mol.L-1.min-1,由方程式可知:
=0.5mol.L-1.min-1,由方程式可知: v(NH3)=
v(NH3)= ×0.5mol.L-1.min-1=0.25mol.L-1.min-1,
×0.5mol.L-1.min-1=0.25mol.L-1.min-1,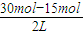 =7.5mol/L,
=7.5mol/L,

 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:

| ||
| 高溫高壓 |
| ||
| 高溫高壓 |
| 化學鍵 | H-H | N≡N | H-N |
| 生成(或斷裂)1mol化學鍵時放出(或吸收)的能量 | 436kJ | 946kJ | 390kJ |
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
| 一定條件 |
| 時間/min | 0 | 30 | 70 | 80 | 100 |
| n(CO2)/mol | 0.10 | 0.060 | 0.040 | 0.040 | 0.040 |
查看答案和解析>>
科目:高中化學 來源:2011-2012學年湖南省瀏陽一中高一上學期第一次階段性測試化學試卷 題型:填空題
工業合成氨的反應N2+3H2= 2NH3的能量變化如下圖所示,請回答有關問題: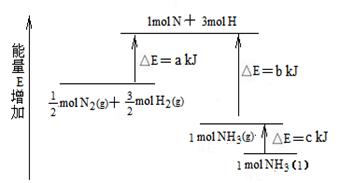
(1).合成 1 mol NH3(l) ____________(填“吸收”、“放出”)_____________kJ的熱量。
(2).已知:拆開 lmol H—H 鍵、lmol N-H 鍵、lmol N≡N 鍵分別需要的能量是436kJ、391kJ、946kJ。則上圖中的a=_______________kJ;1 mol N2(g) 完全反應生成NH3(g)產生的能量變化為 ______KJ。
(3).推測反應 2NH3(l)= N2(g)+3H2(g) 比反應 2NH3 (g)= N2(g)+3H2(g)______________(填“吸收”、“放出”)的熱量_____________(填“多”、“少”)。
查看答案和解析>>
科目:高中化學 來源:2013-2014學年湖北省荊州市畢業班質量檢查(一)化學試卷(解析版) 題型:填空題
氨氣是一種重要的化工產品,是生產銨鹽、尿素等的原料。工業合成氨的反應如下:N2(g) +3H2(g)  2NH3(g)
△H=一92. 4 KJ·mol-1
2NH3(g)
△H=一92. 4 KJ·mol-1
(1)2NH3(g)  N2(g)
+3H2(g)在恒容密閉容器中達到平衡的標志有
N2(g)
+3H2(g)在恒容密閉容器中達到平衡的標志有
①單位時間內生成3n mol H2:同時生成2n mol NH3②用NH3、N2、H2表示反應速率比為2∶1∶3 ③混合氣體的密度不再改變 ④混合氣體壓強不再改變 ⑤混合氣體平均相對分子質量不再改變
A.①③④ B.①②④⑤ C.①④⑤ D.②③④
(2)工業上常用CO2和NH3通過如下反應合成尿素[CO(NH2)2]。

t℃時,向容積恒定為2L的密閉容器中加入0.10 molCO:和0. 40 molNH3 ,70 min開始達到平衡。反應中CO2 ( g)的物質的量隨時間變化如下表所示:
|
時間/min |
0 |
30 |
70 |
80 |
100 |
|
n(CO2) /mol |
0.10 |
0.060 |
0.040 |
0.040 |
0.040 |
①20 min時,υ正(CO2 )_ 80 min時。υ逆(H2O)(填“>”、“=”或“<”)。
②在100 min時,保持其它條件不變,再向容器中充入0. 050 mo1CO2和0. 20 molNH3,重新建立平衡后CO2的轉化率與原平衡相比將_ (填“增大”、“不變”或“減小”)。
③上述可逆反應的平衡常數為_ (保留二位小數)。
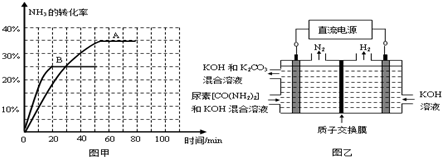
④根據表中數據在圖甲中繪制出在t℃下NH3的轉化率隨時間變化的圖像;保持其它條件不變;則(t+10)℃下正確的圖像可能是 (填圖甲中的“A”或“B”)。

⑤圖乙所示裝置(陰、陽極均為惰性電極)可用于電解尿素〔CO(NH2)2〕的堿性溶液制取氫氣。該裝置中陽極的電極反應式為 ,若兩極共收集到氣體22. 4L(標
況),則消耗的尿素為 g(忽略氣體的溶解)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com