
 已知A、B、C、D均為前四周期元素且原子序數依次增大,元素A的基態原子2p軌道有3個未成對電子,元素B的原子最外層電子數是其內層電子數的3倍,元素C的一種常見單質為淡黃色粉末,D的內層軌道全部排滿電子,且最外層電子數為l.
已知A、B、C、D均為前四周期元素且原子序數依次增大,元素A的基態原子2p軌道有3個未成對電子,元素B的原子最外層電子數是其內層電子數的3倍,元素C的一種常見單質為淡黃色粉末,D的內層軌道全部排滿電子,且最外層電子數為l.分析 A、B、C、D均為前四周期元素且原子序數依次增大,元素A的基態原子2p軌道有3個未成對電子,核外電子排布為1s22s22p3,則A為N元素;元素B的原子最外層電子數是其內層電子數的3倍,原子只能有2個電子層,最外層電子數為6,則B為O元素;元素C的一種常見單質為淡黃色粉末,則C為S元素;D的內層軌道全部排滿電子,且最外層電子數為l,原子序數大于S,只能處于第四周期,核外電子數=2+8+18+1=29,則D為Cu元素,據此解答.
解答 解:A、B、C、D均為前四周期元素且原子序數依次增大,元素A的基態原子2p軌道有3個未成對電子,核外電子排布為1s22s22p3,則A為N元素;元素B的原子最外層電子數是其內層電子數的3倍,原子只能有2個電子層,最外層電子數為6,則B為O元素;元素C的一種常見單質為淡黃色粉末,則C為S元素;D的內層軌道全部排滿電子,且最外層電子數為l,原子序數大于S,只能處于第四周期,核外電子數=2+8+18+1=29,則D為Cu元素,
(1)同周期隨原子序數增大,元素第一電離能呈增大趨勢,但氮元素原子2p軌道容納3個電子,為半滿穩定狀態,能量較低,第一電離能高于O元素,所以第二周期中F、Ne的第一電離能都高于N元素,
故答案為:2;
(2)CB2分子為SO2,分子中硫原子的價層電子對為$\frac{6}{2}$=3,有一對孤電子對,所以分子的空間構型為V形;水分子與乙醇分子之間形成氫鍵,故H2O在乙醇中的溶解度大于H2S,
故答案為:V形;水分子與乙醇分子之間形成氫鍵;
(3)NO3-中N原子價層電子對數=3+$\frac{5+1-2×3}{2}$=3,N原子軌道的雜化類型是sp2,與NO3-互為等電子體微粒的化學式為SO3、BF3、CO32-、SiO32-等,
故答案為:sp2;SO3、BF3、CO32-、SiO32-等;
(4)Cu(OH)2難溶于水,易溶于氨水,其溶于氨水的離子方程式為:Cu(OH)2+4NH3.H2O=[Cu(NH3)4]2++2OH-+4H2O,
故答案為:Cu(OH)2+4NH3.H2O=[Cu(NH3)4]2++2OH-+4H2O;
(5)Cu2O的晶胞中黑色球數目=4、白色球數目=2+8×$\frac{1}{8}$=2,故黑色球為Cu、白色球為O,晶胞質量=2×$\frac{64×2+16}{{N}_{A}}$g,晶體的密度為ρ g•cm-3,則晶胞體積=$\frac{\frac{64×2+16}{{N}_{A}}×2}{ρ}$cm3=$\frac{288}{ρ{N}_{A}}$cm3,則晶胞邊長=$\root{3}{\frac{288}{ρ{N}_{A}}}$cm,
故答案為:$\root{3}{\frac{288}{ρ{N}_{A}}}$.
點評 本題是對物質結構的考查,涉及電離能、分子結構、雜化軌道、等電子體、配合物、晶胞計算等,推斷元素是解題關鍵,需要學生具備扎實的基礎,難度中等.


 黃岡小狀元解決問題天天練系列答案
黃岡小狀元解決問題天天練系列答案科目:高中化學 來源: 題型:選擇題
| A. | 若n=4,則X是第四周期元素 | |
| B. | 若n=3,則Z可能等于25 | |
| C. | 若X是第四周期元素,則具有“ns2np6nd5”排布的原子一定只有2種 | |
| D. | 若n=4,則X的基態原子一定有10個s電子 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氫鍵; 分子間作用力; 非極性鍵 | |
| B. | 氫鍵; 氫鍵; 極性鍵 | |
| C. | 氫鍵; 極性鍵; 分子間作用力 | |
| D. | 分子間作用力; 氫鍵; 非極性鍵 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 254 g I2(g)中通入2 g H2(g),反應放熱9.48 kJ | |
| B. | 1 mol固態碘與1 mol氣態碘所含的能量相差17.00 kJ | |
| C. | 反應(ⅱ)的反應物總能量比反應(ⅰ)的反應物總能量低 | |
| D. | 反應(ⅰ)的產物比反應(ⅱ)的產物穩定 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
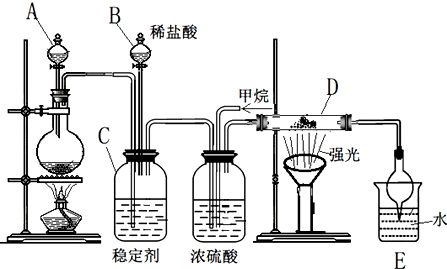
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
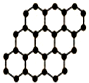 C和Si元素在化學中占有極其重要的地位.
C和Si元素在化學中占有極其重要的地位.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com