
 有X、Y、Z、W、P、Q六種前兩周期的主族元素,原子序數依次增大,價電子數之和為26,原子半徑依Y、Z、W、P、Q、X依次減小.圍繞上述元素,回答下列問題:
有X、Y、Z、W、P、Q六種前兩周期的主族元素,原子序數依次增大,價電子數之和為26,原子半徑依Y、Z、W、P、Q、X依次減小.圍繞上述元素,回答下列問題: ,YQ3中心原子的雜化類型為sp2,Z與Q兩元素第一電離能的大小關系:Z<Q(填“>”、“<”或“=”).
,YQ3中心原子的雜化類型為sp2,Z與Q兩元素第一電離能的大小關系:Z<Q(填“>”、“<”或“=”). ,其與水反應的化學方程式為NH4H+H2O=NH3•H2O+H2↑.
,其與水反應的化學方程式為NH4H+H2O=NH3•H2O+H2↑.分析 有X、Y、Z、W、P、Q六種前兩周期的主族元素,由原子序數X<Y,原子半徑X<Y,可知X只能處于第一周期,其余元素處于第二周期,故X為H元素;Y、Z、W、P、Q原子序數依次增大,原子半徑依Y、Z、W、P、Q依次減小,則最外層電子數依次增大,它們最外層電子數之和為26-1=25,最外層電子數只能分別為3、4、5、6、7,故Y為B、Z為C、W為N、P為O、Q為F;
(1)Q是F元素,根據核外電子排布畫出其電子排布式;根據價層電子對互斥理論判斷BF3中心原子B原子雜化方式;Z是C元素、Q是F元素,同一周期元素,元素第一電離能隨著原子序數增大而呈增大趨勢,但第IIA族、第VA族元素第一電離能大于其相鄰元素;
(2)氫鍵導致物質的熔沸點升高;
(3)固體A是離子晶體,結構類似于CsCl,組成中含N的質量分數為73.7%,它的所有原子的最外層都符合相應的稀有氣體原子的最外層電子結構,該物質適當加熱就分解成兩種單質氣體,該物質為NH4H,與水反應生成氫氣與一水合氨;
(4)該晶胞中C原子個數=4+8×$\frac{1}{8}$+6×$\frac{1}{2}$=8,設C原子半徑為xcm,則C原子總體積=8×$\frac{4}{3}π$x3cm3,設正六面體棱長為ycm,其體線長=$\sqrt{3}$ycm,距離最近的C原子之間距離為2xcm,這兩個碳原子之間的距離等于正六面體體長的$\frac{1}{4}$,所以2xcm=$\frac{\sqrt{3}}{4}y$cm,晶胞體積=y3cm3,空間利用率=$\frac{原子總體積}{晶胞體積}×100%$.
解答 解:有X、Y、Z、W、P、Q六種前兩周期的主族元素,由原子序數X<Y,原子半徑X<Y,可知X只能處于第一周期,其余元素處于第二周期,故X為H元素;Y、Z、W、P、Q原子序數依次增大,原子半徑依Y、Z、W、P、Q依次減小,則最外層電子數依次增大,它們最外層電子數之和為26-1=25,最外層電子數只能分別為3、4、5、6、7,故Y為B、Z為C、W為N、P為O、Q為F.
(1)Q為F元素,其電子排布圖為 ,BF3中心原子B原子價層電子對數為3+$\frac{1}{2}$(3-1×3)=3,故B原子采取sp2雜化;同一周期元素,元素第一電離能隨著原子序數增大而呈增大趨勢,但第IIA族、第VA族元素第一電離能大于其相鄰元素,所以第一電離能C<F,
,BF3中心原子B原子價層電子對數為3+$\frac{1}{2}$(3-1×3)=3,故B原子采取sp2雜化;同一周期元素,元素第一電離能隨著原子序數增大而呈增大趨勢,但第IIA族、第VA族元素第一電離能大于其相鄰元素,所以第一電離能C<F,
故答案為: ;sp2雜化;<;
;sp2雜化;<;
(2)H2O和CO2固態時均為分子晶體,但H2O分子存在分子間氫鍵,熔點H2O比CO2高得多,
故答案為:H2O分子存在分子間氫鍵;
(3)固體A是離子晶體,結構類似于CsCl,組成中含N的質量分數為73.7%,它的所有原子的最外層都符合相應的稀有氣體原子的最外層電子結構,該物質適當加熱就分解成兩種單質氣體,該物質為NH4H,該物質的電子式為 ,其與水反應的化學方程式為NH4H+H2O=NH3•H2O+H2↑,
,其與水反應的化學方程式為NH4H+H2O=NH3•H2O+H2↑,
故答案為: ;NH4H+H2O=NH3•H2O+H2↑;
;NH4H+H2O=NH3•H2O+H2↑;
(4)該晶胞中C原子個數=4+8×$\frac{1}{8}$+6×$\frac{1}{2}$=8,設C原子半徑為xcm,則C原子總體積=8×$\frac{4}{3}π$x3cm3,設正六面體棱長為ycm,其體線長=$\sqrt{3}$ycm,距離最近的C原子之間距離為2xcm,這兩個碳原子之間的距離等于正六面體體長的$\frac{1}{4}$,所以2xcm=$\frac{\sqrt{3}}{4}y$cm,所以$\frac{x}{y}$=$\frac{\sqrt{3}}{8}$,晶胞體積=y3cm3,空間利用率=$\frac{原子總體積}{晶胞體積}×100%$=$\frac{8×\frac{4}{3}×π×{x}^{3}}{{y}^{3}}$×100%=8×$\frac{4}{3}$×π×($\frac{\sqrt{3}}{8}$)3×100%=33.99%,故答案為:33.99%.
點評 本題考查物質結構和性質,涉及晶胞計算、電子式的書寫、原子雜化方式判斷、氫鍵等知識點,綜合性較強,難點是晶胞計算,明確晶胞中距離最近的兩個碳原子之間距離與晶胞體長關系是解本題關鍵,同時考查學生計算及空間想象能力,題目難度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:選擇題
| A. | 向含有等物質的量的Ba(OH)2、KOH、的混合溶液中通入CO2;與CO2反應的物質依次是KOH、Ba(OH)2、BaCO3 | |
| B. | 向含有等物質的量的Fe2+、Ag+、Cu2+ 的混合溶液中加入Zn:與Zn反應的離子依次是Ag+、Cu2+、Fe2+ | |
| C. | 向含有等物質的量的AlO2?、OH-、CO32- 的混合溶液中滴加鹽酸:與鹽酸反應的物質依次是AlO2-、Al(OH)3、OH-、CO32- | |
| D. | 向含有等物質的量的AlCl3、HCl的混合溶液中滴加NaOH溶液,與NaOH反應的物質依次是AlCl3、HCl、Al(OH)3 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 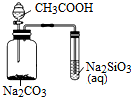 不能用來檢驗CH3COOH、H2CO3、H2SiO3酸性的強弱 | |
| B. | 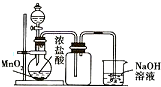 可用來制取并收集氯氣 | |
| C. | 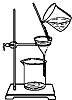 可用來分離氫氧化鐵膠體中的膠體粒子 | |
| D. | 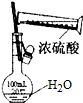 可用來配制一定物質的量濃度的稀硫酸 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 每消耗1molCH4可以向外電路轉移4mol電子 | |
| B. | 負極上CH4失去電子,電極反應式為CH4+10OH--8e-═CO32-+7H2O | |
| C. | 負極上是O2獲得電子,電極反應式為:O2+2H2O+4e-═4OH- | |
| D. | 電池放電后,溶液pH不斷升高 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
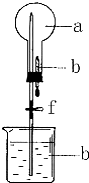 如圖的裝置中,干燥燒瓶中盛有某種氣體,燒杯和滴管內盛放某種溶液.擠壓滴管的膠頭,下列與試驗事實不相符的是( )
如圖的裝置中,干燥燒瓶中盛有某種氣體,燒杯和滴管內盛放某種溶液.擠壓滴管的膠頭,下列與試驗事實不相符的是( )| A. | CO2(NaHCO3溶液)無色噴泉 | B. | NH3(H2O含酚酞)紅色噴泉 | ||
| C. | Cl2(NaOH溶液)無色噴泉 | D. | HCl(AgNO3溶液)白色噴泉 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | +30.67 | B. | -345.3 | C. | -30.67 | D. | +345.3 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 常溫常壓下,3.0g含甲醛的冰醋酸中含有的原子總數為0.4 NA | |
| B. | 標準狀況下,2.24L苯中含有的C-H鍵的數目為0.6NA | |
| C. | 1 L 0.01 mol•L-1 KAl(SO4)2溶液中,含有的陽離子數目為0.02NA | |
| D. | 反應KIO3+6HI=3I2+KI+3H2O,每生成1.5mol I2轉移電子數為3NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 電解過程產生的氣體體積(在標準狀況下)為5.6 L | |
| B. | 電解過程只發生了2CuSO4+2H2O$\frac{\underline{\;電解\;}}{\;}$2Cu+O2↑+2H2SO4 | |
| C. | 電解過程轉移的電子數為3.612×1023個 | |
| D. | 加入的堿式碳酸銅的反應是:Cu2(OH)2CO3+2H2SO4═2CuSO4+CO2↑+3H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
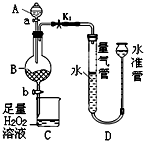 工業生產中會產生大量的廢鐵屑,可將其“變廢為寶”制成化工原料氯化鐵.實驗室中利用如圖所示裝置探究由廢鐵屑制備FeCl3•6H2O晶體的原理并測定鐵屑中鐵單質的質量分數(雜質不溶于水且不與酸反應).
工業生產中會產生大量的廢鐵屑,可將其“變廢為寶”制成化工原料氯化鐵.實驗室中利用如圖所示裝置探究由廢鐵屑制備FeCl3•6H2O晶體的原理并測定鐵屑中鐵單質的質量分數(雜質不溶于水且不與酸反應).查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com