
【題目】N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4KJ/mol。在500℃、20MPa時,將N2和H2通入到體積為2L的密閉容器中,反應過程中各種物質的物質的量變化如圖所示:
2NH3(g) ΔH=-92.4KJ/mol。在500℃、20MPa時,將N2和H2通入到體積為2L的密閉容器中,反應過程中各種物質的物質的量變化如圖所示:
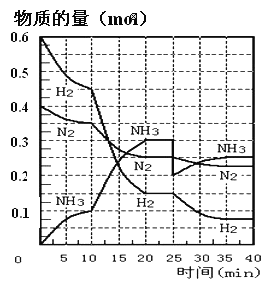
(1)10min內用NH3表示該反應的平均速率,v(NH3)= _______。
(2)在10-20min內NH3濃度變化的原因可能是_______(填字母)。
a.加了催化劑 b.降低溫度 c.增加NH3的物質的量
(3)該可逆反應達到平衡的標志是___(填字母)
a.3v(H2)正=2v(NH3)逆
b.混合氣體的密度不再隨時間變化
c.容器內的總壓強不再隨時間而變化
d.N2、H2、NH3的分子數(shù)之比為1:3:2
e.單位時間生成mmolN2的同時消耗3mmolH2
f.amolN=N鍵斷裂的同時,有6amolN-M鍵合成
(4)第一次平衡時,平衡常數(shù)K1=____(用數(shù)學表達式表示)。NH3的體積分數(shù)是_____(保留2位小數(shù))。
(5)在反應進行到25min時,曲線發(fā)生變化的原因是______。
(6)已知:N2(g)+3H2![]() 2NH3(g) ΔH=-92.4KJ/mol
2NH3(g) ΔH=-92.4KJ/mol
2H2(g)+O2(g)![]() 2H2O(g) ΔH=-483.6KJ/mol
2H2O(g) ΔH=-483.6KJ/mol
氨氣完全燃燒生成氣態(tài)水的熱化學方程式是______
(7)安陽燃料電池具有很大的發(fā)展?jié)摿Α0碴柸剂想姵毓ぷ髟砣鐖D所示:
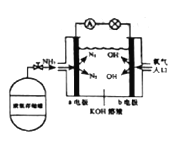
①b電極的電極反應式是_________;
②一段時間后,需向裝置中補充KOH,請依據反應原理解釋原因是_____。
【答案】 v(NH3)= 0.005 mol/(L·min) a c e 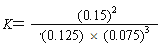 42.86% 移走了生成的氨氣(或減小了氨氣的濃度) 4NH3(g) + 3O2(g)
42.86% 移走了生成的氨氣(或減小了氨氣的濃度) 4NH3(g) + 3O2(g) ![]() 2N2(g) + 6H2O(g) ΔH =-1266.0 kJ/mol O2 + 4e- + 2H2O= 4OH- 由于發(fā)生4NH3 + 3O2
2N2(g) + 6H2O(g) ΔH =-1266.0 kJ/mol O2 + 4e- + 2H2O= 4OH- 由于發(fā)生4NH3 + 3O2![]() 2N2 + 6H2O 反應,有水生成,使得溶液逐漸變稀,所以要補充KOH。
2N2 + 6H2O 反應,有水生成,使得溶液逐漸變稀,所以要補充KOH。
【解析】(1)根據反應速率的表達式,c(NH3)=0.1/(2×10)mol/(L·min)=0.005mol/(L·min);(2)由圖像可知,各組分物質的量變化增加,,且10min時變化是連續(xù)的,20min達到平衡時,N2的物質的量變化量為0.025×4mol=0.1mol,氫氣的物質的量變化量為0.025×12mol=0.3mol,NH3物質的量變化量為0.025×8mol=0.2mol,物質的量變化之比等于化學計量時之比,三種氣體物質的速率增加倍數(shù)相同,說明使用了催化劑,故選項a正確;(3)a、用不同物質反應速率判斷達到平衡,要求反應方向一正一逆,且反應速率之比等于化學計量數(shù)之比,v正(H2)向正反應方向進行,v逆(NH3)向逆反應方向進行,v正(H2)/v逆(NH3)=3:2,應是2v正(H2)=3v逆(NH3),故錯誤;b、組分都是氣體,氣體質量保持不變,又是恒容狀態(tài),因此密度不變,不能說明反應達到平衡,故錯誤;c、反應前后氣體系數(shù)之和不相等,因此壓強不變,說明反應達到平衡,故正確;d、因為不知道開始時投入量是多少,因此分子數(shù)之比不能判斷是否達到平衡,故錯誤;e、反應方向一正一逆,且等于反應速率之比,因此達到平衡,故正確;f、反應方向都是向正反應方向進行,因此不能說明達到平衡,故錯誤;(4)根據平衡常數(shù)的定義,表達式為K1=c2(NH3)/[c(N2)×c3(H2)],在20min時第一次達到平衡,n(N2)=0.25mol,n(H2)=0.15mol,n(NH3)=0.3mol,因此有K=(0.3/2)2/[(0.25/2)×(0.15/2)3]或者 ,NH3的體積分數(shù)為0.3/(0.25+0.15+0.3)×100%=42.86%;(5)根據圖像,第25min時,氨氣的量突然減小,而其他物質的量不變,說明此時刻移出NH3或分離出NH3;(6)①N2(g)+3H2(g)
,NH3的體積分數(shù)為0.3/(0.25+0.15+0.3)×100%=42.86%;(5)根據圖像,第25min時,氨氣的量突然減小,而其他物質的量不變,說明此時刻移出NH3或分離出NH3;(6)①N2(g)+3H2(g) ![]() 2NH3(g),②2H2(g)+O2(g)=2H2O(g),②×3-2×①得出:4NH3(g) + 3O2(g)
2NH3(g),②2H2(g)+O2(g)=2H2O(g),②×3-2×①得出:4NH3(g) + 3O2(g) ![]() 2N2(g) + 6H2O(g) ΔH =-1266.0 kJ/mol ;(7)①根據工作原理,b極發(fā)生還原反應,電極反應式為O2+2H2O+4e-=4OH-;②總電極反應是4NH3+O2
2N2(g) + 6H2O(g) ΔH =-1266.0 kJ/mol ;(7)①根據工作原理,b極發(fā)生還原反應,電極反應式為O2+2H2O+4e-=4OH-;②總電極反應是4NH3+O2![]() 2N2+6H2O,KOH的濃度降低,因此需要補充KOH。
2N2+6H2O,KOH的濃度降低,因此需要補充KOH。


 怎樣學好牛津英語系列答案
怎樣學好牛津英語系列答案科目:高中化學 來源: 題型:
【題目】化學與生產、生活密切相關。下列說法不正確的是
A. 食鹽可作調味劑,也可用作食品防腐劑
B. 二氧化硫可用于制作葡萄酒的食品添加劑
C. 還原鐵粉和生石灰均可用作食品包裝袋內的脫氧劑
D. “地溝油”禁止食用,但可用來制取肥皂
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列反應的離子方程式正確的是( )
A. Na2O2與H2O反應:2Na2O2+2H2O===4Na++4OH-+O2↑
B. 澄清石灰水中通入少量的CO2:CO2+OH-===HCO![]()
C. Mg(OH)2與鹽酸反應:OH-+H+===H2O
D. Zn與AgNO3溶液反應:Zn+Ag+===Zn2++Ag
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,向20mL某鹽酸溶液中逐滴加入0.1mol/L的氨水,溶液pH的變化與加入氨水的體積關系如圖所示,下列敘述正確的是

A. 鹽酸的物質的量濃度為1mol/L
B. 在①、②之間的任意一點:c(Cl﹣)>c(NH4+),c(H+)>c(OH﹣)
C. 在點③所示溶液中:由水電離出的c(OH﹣)>10﹣7mol/L
D. 在點②所示溶液中:c(NH4+)=c(Cl﹣)>c(OH﹣)=c(H+),且V <20
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】T℃時,在2L恒容密閉容器中氣態(tài)物質X、Y、Z的物質的量隨時間變化的部分數(shù)據如表所示:
T/min | n(X) /mol | n(Y) /mol | n(Z) /mol |
0 | 0.80 | 1.00 | 0 |
1 | 0.70 | 0.80 | 0.20 |
5 | 0.70 | ||
9 | 0.40 | ||
10 | 0.40 | 0.80 |
(1)寫出該反應的化學方程式_________________
(2)反應進行到10min,X的轉化率為___________,0~5min內Y的平均反應速率為___________
(3)計算T℃時該反應的平衡常數(shù)K=____________
(4)T℃下向該密閉容器中通入一定量的X、Y、Z,反應到某時刻測得X、Y、Z的物質的量分別為1.00mol、0.50mol、1.60mol,則此時正逆反應速率大小:v正 v逆(填“大于”、“等于”、“小于”)
(5)若在10min和t3、t5時刻分別改變該反應的某一反應條件,得到X、Z的物質的量及反應速率與時間的關系如下圖A、B所示:

10min時改變的反應條件是_______________
②t3時刻改變的反應條件是_______________
③t5時刻改變的反應條件是 ,理由是___________________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(2015天津)隨原子序數(shù)的遞增,八種短周期元素(用字母X表示)原子半徑的相對大小、最高正價或最低負價的變化如下圖所示。

根據判斷出的元素回答問題:
(1)f在元素周期表的位置是__________。
(2)比較d、e常見離子的半徑的小(用化學式表示,下同)_______>__________;比較g、h的最高價氧化物對應的水化物的酸性強弱是:_______>__________。
(3)任選上述元素組成一種四原子共價化合物,寫出其電子式__________。
(4)已知1mole的單質在足量d2中燃燒,恢復至室溫,放出255.5kJ熱量,寫出該反應的熱化學方程式:___________________。
(5)上述元素可組成鹽R:zx4f(gd4)2,向盛有10mL1mol·L-1R溶液的燒杯中滴加1mol·L-1NaOH溶液,沉淀物質的量隨NaOH溶液體積變化示意圖如下:

① R離子濃度由大到小的順序是:__________。
② 寫出m點反應的離子方程式_________________。
③ 若R溶液改加20mL1.2 mol·L-1Ba(OH)2溶液,充分反應后,溶液中產生沉淀的物質的量為______mol。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列數(shù)據不一定隨著溫度升高而增大的是
A. 化學反應速率υ B. 化學平衡常數(shù)K
C. 弱電解質的電離平衡常數(shù)K D. 水的離子積常數(shù)Kw
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】NH4Al(SO4)2是食品加工中最為快捷的食品添加劑,用于焙烤食品中;NH4HSO4在分析試劑、醫(yī)藥、電子工業(yè)中用途廣泛,請回答下列問題:

(1)相同條件下,pH相同的NH4Al(SO4)2中c(NH4+)_________(填“=”、“>” 或“<”)NH4HSO4中c(NH4+)。
(2)如圖一是0.1 molL-1 NH4Al(SO4)2溶液的pH隨溫度變化的圖象。
①其中符合0.1 molL-1 NH4Al(SO4)2的pH隨溫度變化的曲線是___________(填寫字母);
②室溫時,0.1 molL-1 NH4Al(SO4)2中2c(SO42-)-c(NH4+)-3c(Al3+)=_________molL-1(填數(shù)值)
(3)室溫時,向100 mL 0.1molL-1 NH4HSO4溶液中滴加0.1molL-1 NaOH溶液,得到的溶液pH與NaOH溶液體積的關系曲線如圖二所示。試分析圖中a、b、c、d四個點,水的電離程度最大的是_____________;在c點,溶液中各離子濃度由大到小的排列順序是____________ 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用下圖所示裝置除去含CN-、Cl-廢水中的CN-時,控制溶液pH為9~10,陽極產生的ClO-將CN-氧化為兩種無污染的氣體,下列說法不正確的是

A. 用石墨作陽極,鐵作陰極
B. 陽極的電極反應式為:Cl-+ 2OH--2e-= ClO-+ H2O
C. 陰極的電極反應式為:2H2O + 2e-= H2↑ + 2OH-
D. 除去CN-的反應:2CN-+ 5ClO-+ 2H+= N2↑ + 2CO2↑ +5Cl-+ H2O
查看答案和解析>>
湖北省互聯(lián)網違法和不良信息舉報平臺 | 網上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com