
【題目】某小組取一定質量的FeSO4固體,利用下圖裝置進行實驗.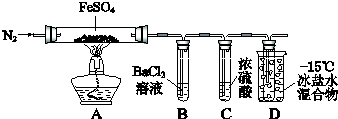
實驗過程 | 實驗現象 | |
① | 通入一段時間N2 , 加熱 | A中固體變為紅棕色,B中有白色沉淀,D試管中有無色液體 |
② | 用帶有火星的木條靠近裝置D的導管口 | 木條復燃 |
③ | 充分反應,停止加熱,冷卻后,取A中固體,加鹽酸 | 固體溶解,溶液呈黃色 |
④ | 將③所得溶液滴入D試管中 | 溶液變為淺綠色 |
已知:SO2 熔點﹣72℃,沸點﹣10℃;SO3熔點16.8℃,沸點44.8℃.
(1)實驗③反應的離子方程式是 .
(2)分解過程除產生使木條復燃的氣體外,僅由A中固體顏色變化推測,還一定有氣體,依據是 .
(3)實驗④反應的離子方程式是 .
(4)某同學依據B中的現象,認為FeSO4分解一定有SO3生成.你認為是否正確,原因是(用必要的文字和化學方程式解釋)
【答案】
(1)Fe2O3+6H+=2Fe3++3H2O
(2)SO2;因為有Fe2O3生成,在FeSO4中只有+6價S元素有氧化性,能被還原.因此一定有SO2生成
(3)2Fe3++SO2+2H2O=2Fe2++SO42﹣+4H+
(4)不正確,因為分解有O2和SO2生成,在水溶液中發生反應:2SO2+O2+2H2O=2H2SO4 , 故無論分解反應是否有SO3生成,都會有此現象,2SO2+O2+2H2O+2BaCl2=2BaSO4↓+4HCl.
【解析】解:(1)根據②木條復燃說明有氧氣生成,根據A中固體變為紅棕色,說明A中固體變為紅棕色為氧化鐵,B中有白色沉淀為硫酸鋇,是因為硫酸亞鐵在氮氣的條件下隔絕空氣加熱分解生成氧化鐵、二氧化硫,所以實驗③反應的離子方程式是Fe2O3+6H+=2Fe3++3H2O,故答案為:Fe2O3+6H+=2Fe3++3H2O;(2)根據氧化還原反應的特點,元素化合價升高的價數等于元素化合價降低的價數,分解過程除產生使木條復燃的氣體為氧氣說明氧元素的化合價在升高,A中固體變為紅棕色為氧化鐵,因為有Fe2O3生成,鐵的化合價也在升高,在FeSO4中只有+6價S元素有氧化性,能被還原,因此一定有SO2生成,故答案為:SO2;因為有Fe2O3生成,在FeSO4中只有+6價S元素有氧化性,能被還原.因此一定有SO2生成;(3)取A中固體,加鹽酸Fe2O3+6HCl=2FeCl3+3H2O,將③所得溶液滴入D試管中,溶液變為淺綠色說明有二價鐵生成,說明三價鐵離子被還原,D試管中有無色液體為二氧化硫,發生的反應為2Fe3++SO2+2H2O=2Fe2++SO42﹣+4H+ , 故答案為:2Fe3++SO2+2H2O=2Fe2++SO42﹣+4H+;(4)因為硫酸亞鐵在氮氣的條件下隔絕空氣加熱分解一定生成氧化鐵、二氧化硫,不一定有三氧化硫,B中的現象是有白色沉淀生成,白色沉淀為硫酸鋇,該沉淀可能是2SO2+O2+2H2O=2H2SO4 , H2SO4+BaCl2=BaSO4↓+2HCl,故無論分解反應是否有SO3 生成,都會有此現象,總反應為2SO2+O2+2H2O+2BaCl2=2BaSO4↓+4HCl,故答案為:不正確,因為分解有O2 和SO2 生成,在水溶液中發生反應:2SO2+O2+2H2O=2H2SO4 , 故無論分解反應是否有SO3 生成,都會有此現象;2SO2+O2+2H2O+2BaCl2=2BaSO4↓+4HCl.(1)A中固體變為紅棕色為氧化鐵;然后加鹽酸,是氧化鐵和鹽酸反應,據此書寫離子反應方程式;(2)分解過程除產生使木條復燃的氣體為氧氣,A中固體變為紅棕色為氧化鐵,因為有Fe2O3生成,在FeSO4中只有+6價S元素有氧化性,能被還原,因此一定有SO2生成;(3)A為氧化鐵加鹽酸生成三價鐵離子,將③所得溶液滴入D試管中,溶液變為淺綠色說明有二價鐵生成,所以三價鐵離子和二氧化硫發生了氧化還原反應,據此解答;(4)FeSO4分解不一定有SO3生成,B中的現象是有白色沉淀生成,可能是在水溶液中發生反應:2SO2+O2+2H2O=2H2SO4 , H2SO4+BaCl2=BaSO4↓+2HCl,故無論分解反應是否有SO3 生成,都會有此現象,據此解答.


科目:高中化學 來源: 題型:
【題目】下列說法正確的是( )
A.鉛蓄電池放電時鉛電極發生還原反應
B.電解飽和食鹽水在陽極得到氯氣,陰極得到金屬鈉
C.給鐵釘鍍銅可采用CuSO4作電鍍液
D.生鐵浸泡在食鹽水中發生析氫腐蝕
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是 ( )
A. 氯氣是黃綠色的,C1—是無色的
B. H2在C12中能安靜燃燒,火焰呈蒼白色,瓶口有白色煙霧生成
C. Cl2和H2的混合氣一定會發生爆炸
D. 燃燒時一定要有氧氣參加
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】對于反應MnO2+4HCl(濃)==MnCl2+Cl2↑+2H2O,_____元素化合價降低,_______電子,發生_______反應,被_________;氧化劑是_____________,氧化產物是_____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】現有25℃時0.1mol/L的氨水.請回答以下問題:
(1)若向氨水中加入少量硫酸銨固體,此時溶液中 ![]() (填“增大”、“減小”或“不變”);
(填“增大”、“減小”或“不變”);
(2)若向氨水中加入稀硫酸,使其恰好中和,寫出反應的離子方程式;所得溶液的pH7(填“>”、“<”或“=”),用離子方程式表示其原因;
(3)若向氨水中加入稀硫酸至溶液的pH=7,此時c(NH4+)=amol/l,則c(SO ![]() )=;
)=;
(4)若向氨水中加入pH=1的硫酸,且氨水與硫酸的體積比為1:1,則所得溶液中各離子物質的量濃度由大到小的關系是 .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用二氧化氯(ClO2)、鐵酸鈉(Na2FeO4摩爾質量為166g/mol)等新型凈水劑替代傳統的凈水劑Cl2對淡水進行消毒是城市飲用水處理新技術.ClO2和Na2FeO4在水處理過程中分別被還原為Cl﹣和Fe3+ .
(1)如果以單位質量的氧化劑所得到的電子數來表示消毒效率,那么,ClO2、Na2FeO4、Cl2三種消毒殺菌劑的消毒效率由大到小的順序是>> .
(2)Na2FeO4溶于水會放出一種無色無味氣體,其殺菌消毒、吸附水中的懸浮雜質的原理可用離子方程式表示為 .
(3)工業以CH3OH與NaClO3為原料在酸性條件下制取ClO2 , 同時產生CO2氣體,已知該反應分為兩步進行,第一步為2ClO3﹣+2Cl﹣+4H+=2ClO2↑+Cl2↑+2H2O.①寫出第二步反應的離子方程式 .
②工業生產時需在反應物中加少量Cl﹣ , 其作用是 .
③生產中會發生副反應ClO3﹣+Cl﹣+H+﹣Cl2↑+H2O(未配平),若測得反應后的混合氣體中Cl2的體積分數為3/73,則起始投料時CH3OH與NaClO3的物質的量之比為 .
(4)已知二氧化氯是一種黃綠色有刺激性氣味的氣體,其熔點為﹣59℃,沸點為11.0℃,易溶于水.ClO2也可以看做是亞氯酸(HClO2)和氯酸(HClO3)的混合酸酐.工業上用稍潮濕的KClO3和草酸在60℃時反應制得.某學生用如圖所示的裝置模擬工業制取及收集ClO2 , 其中A為ClO2的發生裝置,B為ClO2的凝集裝置,C為尾氣吸收裝置.請問:①A部分還應添加溫度控制(如水浴加熱)裝置,B部分還應補充什么裝置;
②C中應裝的試劑為 . C中發生反應的化學方程式為: . 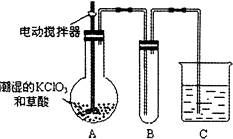
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com