
| A. | 放電時,負極質量增加 | |
| B. | 放電時,溶液中的BF4-向正極移動 | |
| C. | 充電時,陽極附近溶液的酸性增強 | |
| D. | 充電時,陰極的電極反應式為Pb2+-2e-═Pb |
分析 原電池的總反應為:Pb+PbO2+4HBF4$?_{充電}^{放電}$2Pb(BF4)2+2H2O,故放電時負極反應為:Pb-2e-=Pb2+;正極反應:PbO2+2e-+4H+=Pb2++2H2O,陰離子移向負極,陽離子移向正極;充電時,陰極反應:Pb2++2e-=Pb,陽極反應:Pb2++2H2O-2e-=PbO2+4H+,陰離子移向陽極,陽離子移向陰極.據此分析.
解答 解:原電池的總反應為:Pb+PbO2+4HBF4$?_{充電}^{放電}$2Pb(BF4)2+2H2O,故放電時負極反應為:Pb-2e-=Pb2+;正極反應:PbO2+2e-+4H+=Pb2++2H2O,陰離子移向負極,陽離子移向正極;充電時,陰極反應:Pb2++2e-=Pb,陽極反應:Pb2++2H2O-2e-=PbO2+4H+,陰離子移向陽極,陽離子移向陰極.
A、放電時,此裝置為原電池,放電時負極反應為:Pb-2e-=Pb2+,負極的質量減小,故A錯誤;
B、放電時,此裝置為原電池,陰離子BF4-要向負極移動,故B錯誤;
C、充電時,陽極反應:Pb2++2H2O-2e-=PbO2+4H+,產生大量氫離子,故陽極附近溶液的酸性增強,故C正確;
D、充電時的陰極反應即是將放電時的負極反應倒過來,故陰極反應為:Pb2++2e-=Pb,故D錯誤.
故選C.
點評 本題考查了原電池和電解池中電極反應式的書寫和離子移動方向的判斷,應注意的是在原電池中,陰離子移向負極,陽離子移向正極;在電解池中,陰離子移向陽極,陽離子移向陰極,題目難度中等.


 小學期末沖刺100分系列答案
小學期末沖刺100分系列答案 期末復習檢測系列答案
期末復習檢測系列答案 超能學典單元期中期末專題沖刺100分系列答案
超能學典單元期中期末專題沖刺100分系列答案 黃岡360度定制密卷系列答案
黃岡360度定制密卷系列答案科目:高中化學 來源: 題型:解答題
 .Y2Z3遇水很易反應,產生的氣體能使品紅溶液褪色,則其與水反應的化學方程式為2S2Cl2+2H2O═SO2↑+3S↓+4HCl.
.Y2Z3遇水很易反應,產生的氣體能使品紅溶液褪色,則其與水反應的化學方程式為2S2Cl2+2H2O═SO2↑+3S↓+4HCl.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 不移動 | B. | 平衡左移 | C. | 平衡右移 | D. | 無法確定 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
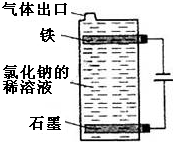 (1)按如圖電解氯化鈉的稀溶液可制得漂白液,寫出該電解池中發生反應的總反應方程式:NaCl+H2O$\frac{\underline{\;電解\;}}{\;}$NaClO+H2↑;
(1)按如圖電解氯化鈉的稀溶液可制得漂白液,寫出該電解池中發生反應的總反應方程式:NaCl+H2O$\frac{\underline{\;電解\;}}{\;}$NaClO+H2↑;查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 加入氯化鋇溶液有白色沉淀生成,再加稀硝酸,沉淀不消失,一定含有SO42- | |
| B. | 觀察鉀元素焰色反應的操作是:將鉑絲放在稀鹽酸中洗滌后灼燒至無色,然后再用鉑絲蘸取固體氯化鉀,置于煤氣燈的火焰上進行灼燒,透過藍色鈷玻璃進行觀察 | |
| C. | 待檢液加入NaOH 溶液并加熱,有能使濕潤的紅色石蕊試紙變藍的氣體生成,則原溶液中一定含有NH4+ | |
| D. | 取少量久置的Na2SO3 樣品于試管中加水溶解,再加入足量鹽酸有氣體產生,然后加入BaCl2 溶液有白色沉淀產生,說明Na2SO3 樣品已部分被氧化 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Na2CO3和稀鹽酸 | B. | Al2O3和NaOH溶液 | ||
| C. | NH4HCO3和NaOH溶液 | D. | CO2和NaOH溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 將4 molCl2通入到含4 mol FeBr2的溶液中:2Cl2+2Fe2++2Br-=4Cl-+Br2+2Fe3+ | |
| B. | 已知亞硫酸(H2SO3)的二級電離常數K2比偏鋁酸(HAlO2)要大.將少量的SO2氣體通入到偏鋁酸鈉溶液中發生的離子反應是:2AlO2-+SO2+3 H2O=2 Al(OH)3↓+SO32- | |
| C. | 稀氨水吸收了少量的二氧化碳氣體:2NH3•H2O+CO2=2NH4++H2O+CO32- | |
| D. | 在明礬溶液中加入氫氧化鋇溶液至沉淀的質量達到最大時發生的離子反應是:2Al3++3SO42-+3Ba2++6OH-=3BaSO4↓+2Al(OH)3↓ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com