
 .
. 、
、 .
.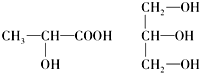
分析 (1)根據元素符號,判斷元素原子的核外電子數,再根據核外電子排布規律來寫;
(2)配合物中含有空軌道的金屬陽離子為中心離子,有孤對電子的原子或離子為配體,配位數就是配體的個數;
(3)計算BCl3分子的中心原子B的價層電子對數,確定VSEPR模型和空間構型,雜化軌道數目和類型、根據空間構性確定鍵角;
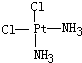
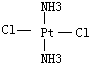
(4)Pt(NH3)2Cl2分子是平面結構,兩個Cl原子有相鄰和相對兩種位置;
(5)連接4個不同原子或原子團的碳原子為手性碳原子.
解答 解:(1)Fe元素為26號元素,原子核外有26個電子,所以核外電子排布式為:1s22s22p63s23p63d64s2或[Ar]3d64s2,Mg2+含有的核外電子數為12-2=10個,核外電子排布式為1s22s22p6,電子排布圖為 ,
,
故答案為:1s22s22p63s23p63d64s2或[Ar]3d64s2; ;
;
(2)根據配合物K3[Co(CN)6]結構分析,含有空軌道的金屬陽離子為中心離子,所以中心離子為Co3+、有孤對電子的原子或離子為配體,所以配體為CN-、配位數就是配體的個數,所以配位數為6,
故答案為:Co3+;CN-;6;
(3)BCl3分子的中心原子B的價層電子對數=3+$\frac{1}{2}$(3-3×1)=3,孤電子對數為0,因此空間構型和VSEPR模型一致,為平面正三角形,因此鍵角為120°,雜化類型為sp2雜化,
故答案為:平面正三角形;sp2;120°;
(4)Pt(NH3)2Cl2分子是平面結構,兩個Cl原子有相鄰和相對兩種位置,故答案為: 、
、 ;
;
(5)手性碳原子連接四個不同的原子或原子團,前者有手性碳原子,后者沒有,故答案為: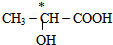 .
.
點評 本題考查了核外電子排布式(圖)、配合物和分子結構、雜化等知識,題目難度中等,熟練掌握原子核外電子排布規律、價層電子對互斥理論和軌道雜化理論是解題的關鍵.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:填空題
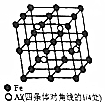 鋁、鐵和銅都是日常生活中常見的金屬,有著廣泛的用途.請回答下列問題:
鋁、鐵和銅都是日常生活中常見的金屬,有著廣泛的用途.請回答下列問題: .
. ,C、N、O三種元素的電負性由大到小的順序為O>N>C.
,C、N、O三種元素的電負性由大到小的順序為O>N>C.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | B的平均消耗速率為0.3mol/(L•min) | |
| B. | 升高溫度時,v正減小,v逆增大 | |
| C. | 若單位時間內生成的B和D的物質的量之比為3:1,則體系處于平衡狀態 | |
| D. | 平衡后,增大壓強,平衡將向正方向移動 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 飽和石灰水、NaOH溶液 | B. | Na2CO3溶液、AgNO3溶液 | ||
| C. | NaHCO3溶液、飽和食鹽水 | D. | 氨水、石灰水 |
查看答案和解析>>
科目:高中化學 來源: 題型:推斷題
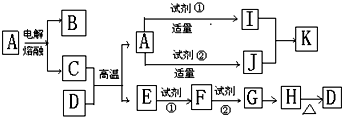
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
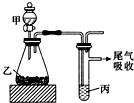 用如圖裝置進行實驗,下列所得結論正確的是( )
用如圖裝置進行實驗,下列所得結論正確的是( )| 甲 | 乙 | 丙 | 結論 | |
| A | 鹽酸 | 石灰石 | 苯酚鈉溶液 | 酸性:HCl>H2CO3>苯酚 |
| B | 鹽酸 | 硫化亞鐵 | 溴水 | 還原性:Cl->Br->S2- |
| C | 濃鹽酸 | 高錳酸鉀 | 溴化鉀溶液 | 氧化性:高錳酸鉀>Cl2>Br2 |
| D | 水 | 電石 | 溴水 | 穩定性:H2O>C2H2>Br2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | “接觸法”制H2SO4時,催化氧化階段的反應原理為:2SO2(g)+O2(g)$?_{△}^{催化劑}$2SO3(g)△H<0 | |
| B. | 海水提鎂的主要步驟為:海水$\stackrel{CaCO_{3}(s)}{→}$Mg(OH)2(s)$\stackrel{鹽酸}{→}$MgCl2(aq)$\stackrel{電解}{→}$Mg(l)+Cl2(g) | |
| C. | 普通水泥的主要成分是硅酸鈣 | |
| D. | 黏土的主要成分是三氧化二鋁. |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 使用聚二氧化碳塑料會產生白色污染 | |
| B. | 聚二氧化碳塑料是通過聚合反應制得的 | |
| C. | 聚二氧化碳塑料與干冰互為同分異構體 | |
| D. | 聚二氧化碳塑干冰都屬于純凈物 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com