
| A. | 當7.8 g Na2O2與H2O完全反應時,有0.2 mol電子發生了轉移 | |
| B. | FeCl2溶液與K3[Fe(CN)6]溶液混合后得到特征藍色沉淀,利用此反應可檢驗Fe2+ | |
| C. | 用濃鹽酸酸化KMnO4溶液以增強其氧化性 | |
| D. | 在3NO2+H2O=2HNO3+NO中,氧化劑和還原劑的質量比為2:1 |
分析 A.若有2 mol Na2O2參加反應,則轉移電子的物質的量為2mol×(1-0)=2 mol,則1molNa2O2完全反應時轉移電子1mol;
B.FeCl2溶液與K3[Fe(CN)6]溶液混合后得到藍色沉淀,為特征反應;
C.高錳酸鉀可氧化HCl;
D.3NO2+H2O=2HNO3+NO中,只有N元素的化合價變化,1molN得到電子與2molN失去電子相同.
解答 解:A.7.8 gNa2O2的物質的量為$\frac{7.8g}{78g/mol}$=0.1mol,與H2O完全反應時,有0.1 mol電子發生了轉移,故A錯誤;
B.FeCl2溶液與K3[Fe(CN)6]溶液混合后得到藍色沉淀,為特征反應,則可利用此反應檢驗Fe2+,故B正確;
C.高錳酸鉀可氧化HCl,不能利用鹽酸酸化,可選硫酸酸化,故C錯誤;
D.3NO2+H2O=2HNO3+NO中,只有N元素的化合價變化,1molN得到電子與2molN失去電子相同,則氧化劑和還原劑均為NO2,其質量比為1:2,故D錯誤;
故選B.
點評 本題考查氧化還原反應,為高頻考點,把握反應中元素的化合價變化為解答的關鍵,側重分析與應用能力的考查,注意選項B為解答的難點,題目難度不大.


 補充習題江蘇系列答案
補充習題江蘇系列答案 學練快車道口算心算速算天天練系列答案
學練快車道口算心算速算天天練系列答案科目:高中化學 來源: 題型:選擇題
| A. | 原子最外層的電子數隨核電荷數的增加而增多 | |
| B. | 單質顏色隨核電荷數的增加而加深 | |
| C. | 氫化物的穩定性隨核電荷數的增加而減弱 | |
| D. | 非金屬性隨核電荷數的增加而減弱 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | I->Fe2+>Cl->SO2 | B. | Cl2>Fe3+>I2>SO2 | C. | Fe2+>I->Cl->SO2 | D. | Cl2>Fe3+>SO2>I2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | c(CH3COOH):①>② | B. | c(CH3COO-):①>② | ||
| C. | c(CH3COOH)+c(CH3COO-):①=② | D. | c(CH3COO-)+c(OH-):①<② |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 物質的量是用來研究微觀粒子的一個國際基本物理量,其單位是摩爾 | |
| B. | 氣體的摩爾體積與溫度和壓強有關,壓強越大,體積越小 | |
| C. | 若x個N(氮)原子的質量是1克,則阿佛加德羅常數可表示為28xmol-1 | |
| D. | 任何一種微觀粒子,當摩爾質量以g/mol為單位時,其數值與這種粒子的相對分子質量或相對原子質量相同 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
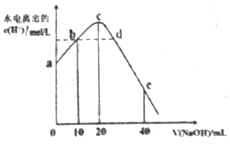 常溫下,向20ml0.01mol•L-1CH3COOH溶液中逐滴加入0.01mol•L-1的NaOH溶液,溶液中水所電離出的c(H+)隨加入NaOH溶液的體積變化示意圖如圖所示,下列說法不正確的是( )
常溫下,向20ml0.01mol•L-1CH3COOH溶液中逐滴加入0.01mol•L-1的NaOH溶液,溶液中水所電離出的c(H+)隨加入NaOH溶液的體積變化示意圖如圖所示,下列說法不正確的是( )| A. | 從a到c,醋酸的電離始終受到促進 | |
| B. | 從b→c的過程中,既存在著pH=7的點,也存在著溶液中水所電離出的c(H+)=10-7的點 | |
| C. | b點:2c(Na+)=c(CH3COO-)+c(CH3COOH) | |
| D. | a、d對應的縱坐標數值分別是:>10-12、>10-7 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 選項 | 實驗操作和現象 | 結論 |
| A | 常溫下分別測等體積、等濃度的醋酸和氨水pH,發現二者的pH 之和為14 | 常溫下,醋酸和氨水的電離平衡常數相等 |
| B | 向均盛有2mL5% H2O2 溶液的兩支試管中分別滴入0.2mol•L-1 FeCl3,和0.3mol.L-1CuCl2 溶lmL,前者生成氣泡的速率更快 | 催化效果:Fe3+>Cu2+ |
| C | 向一定濃度的醋酸溶液中加入鎂條,產生氣泡的速率會先加快再減慢 | 反應剛開始時,醋酸電離平衡正移,c(H+)增大 |
| D | 向硼酸(H3BO3)溶液中滴加少量Na2CO3溶液,觀察到無明顯現象. | H3BO3的酸性弱于H2CO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com