
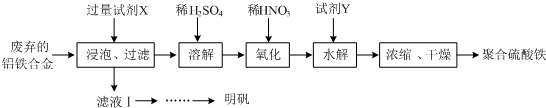

分析 由流程可知,廢棄的鋁鐵合金加入氫氧化鉀溶液浸泡反應鋁反應得到偏鋁酸鉀溶液,過濾,濾液經一系列操作反應生成硫酸鋁鉀,濾渣中加入稀硫酸和鐵反應生成硫酸亞鐵,加入稀硝酸氧化為硫酸鐵,加入試劑Y調節溶液PH,但不能引入新的雜質,加入氧化鐵和酸反應來調節溶液PH,酸性越強,對鐵離子水解程度抑制越大,生成氫氧化鐵少,得到溶液通過蒸發濃縮,冷卻結晶,過濾洗滌,干燥得到聚合硫酸鐵.
(1)①聚合硫酸鐵是一種無毒無害、化學性質穩定、能與水混溶的新型絮凝劑,具有較大表面積能吸附懸浮雜質凈水的作用;
②流程中氧化過程是加入的稀硝酸,會引入雜質,可以改為綠色氧化劑如氧氣、過氧化氫等,聚合硫酸鐵微溶于乙醇,濃縮時向其中加入一定量的乙醇可以利于聚合硫酸鐵析出,乙醇易揮發分析;
③加入氧化鐵和酸反應來調節溶液PH,不引入新的雜質,圖象分析可知PH<3,x值越小,是因為酸性條件下鐵離子水解被抑制;
(2)①明礬是一種常見鋁鉀硫酸鹽,所以為充分利用原料,試劑X應為氫氧化鉀;
②明礬溶解度隨溫度升高溶解度增大,向濾液Ⅰ中加入足量的含鋁廢鐵屑至不再有氣泡產生,過濾除去過量的廢鋁鐵屑,濾液這是鋁和氫氧化鉀溶液反應生成偏鋁酸鉀,加入稀硫酸生成白色沉淀氫氧化鋁,繼續加入稀硫酸沉淀溶解,所得溶液蒸發濃縮、冷卻結晶,過濾,用酒精洗滌晶體,干燥得到明礬晶體.
解答 解(1)①聚合硫酸鐵是一種無毒無害、化學性質穩定、能與水混溶的新型絮凝劑,具有較大表面積能吸附懸浮雜質,有凈水的作用,聚合硫酸鐵可用于凈水的原理是具有吸附作用,
故答案為:聚合硫酸鐵具有吸附作用;
②上述流程中的“氧化”設計存在缺陷,流程中氧化過程是加入的稀硝酸,會引入雜質硝酸根離子,可以改為綠色氧化劑如氧氣、過氧化氫等,氧氣和過氧化氫被還原為水無污染,聚合硫酸鐵微溶于乙醇,濃縮時向其中加入一定量的乙醇,可以降低聚合硫酸鐵的溶解度利于聚合硫酸鐵析出,乙醇易揮發得到晶體易于干燥;
故答案為:將稀HNO3改為H2O2(或O2、O3等);降低聚合硫酸鐵的溶解度,以便析出,所得產物易于干燥;
③加入氧化鐵和酸反應來調節溶液pH,所加試劑Y為Fe2O3,不引入新的雜質;圖象分析可知PH<3,x值越小,是因為酸性條件下鐵離子水解被抑制,分析pH過小(pH<3)導致聚合硫酸鐵中x的值減小,
故答案為:Fe2O3;pH過小,會抑制Fe3+的水解;
(2)①明礬是一種常見鋁鉀硫酸鹽,所以為充分利用原料,試劑X應為KOH,故答案為:KOH;
②明礬溶解度隨溫度升高溶解度增大,向濾液Ⅰ中加入足量的含鋁廢鐵屑至不再有氣泡產生,過濾除去過量的廢鋁鐵屑,濾液中是鋁和氫氧化鉀溶液反應生成偏鋁酸鉀,加入稀硫酸生成白色沉淀氫氧化鋁,繼續加入稀硫酸沉淀溶解,所得溶液蒸發濃縮、冷卻結晶,過濾,用酒精洗滌晶體,干燥得到明礬晶體,
故答案為:向所得濾液中加入稀硫酸,生成白色沉淀,繼續滴加稀硫酸至生成的沉淀溶解;蒸發濃縮;冷卻結晶.
點評 本題考查了物質的制備實驗方案設計,為高考常見題型,側重考查對工藝流程的理解、閱讀題目獲取信息的能力等,難度中等,需要學生具有扎實的基礎知識與靈活運用知識解決問題的能力.


科目:高中化學 來源: 題型:選擇題
| A. | 用蘸有濃氨水的棉棒檢驗輸送氯氣的管道是否漏氣 | |
| B. | 用CO2合成聚碳酸酯可降解塑料,實現“碳”的循環利用 | |
| C. | 大力實施礦物燃料脫硫脫硝技術,能減少二氧化硫、氮氧化物的排放 | |
| D. | 納米鐵粉可以高效地去除被污染水體中的Pb2+、Cu2+、Cd2+、Hg2+等重金屬離子,其本質是納米鐵粉對重金屬離子較強的物理吸附. |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題

查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
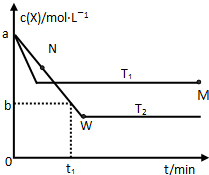 在恒容密閉容器中通入X并發生反應:2X(g)?Y(g),溫度T1、T2下X的物質的量濃度c(X)隨時間t變化的曲線如圖所示.
在恒容密閉容器中通入X并發生反應:2X(g)?Y(g),溫度T1、T2下X的物質的量濃度c(X)隨時間t變化的曲線如圖所示.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| Fe2O3 | CO | Fe | CO2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 2.0 | 1.0 | 1.0 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 二溴乙烷:Br2-CH2-CH2-Br | B. | 3,3,4-三甲基己烷: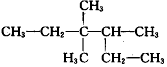 | ||
| C. | 3乙基1丁烯: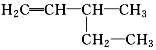 | D. | 2,2,3三甲基戊烷: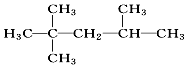 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com